Первый закон термодинамики — это закон сохранения энергии, распространенный на тепловые явления. Он формулируется следующим образом: количество теплоты Q, полученное системой, идет на изменение 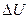 ее внутренней энергии и совершение работы
ее внутренней энергии и совершение работы 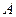 над внешними телами:
над внешними телами:
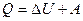 . (8.9)
. (8.9)
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу. A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
|
|
|
Применим первый закон термодинамики к изопроцессам в идеальных одноатомных газах.
1. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно:
 . (8.10)
. (8.10)
Здесь U1 и U2 – внутренние энергии газа в начальном и конечном состояниях. При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Обращаем внимание, что количество теплоты можно рассчитывать либо через изменение температуры, либо через значения давления и объема в начальном и конечном состоянии газа.
2. В изобарном процессе (p = const) газ совершает работу, меняется его температура, а значит, и внутренняя энергия. Следовательно:
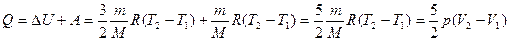 . (8.11)
. (8.11)
При изобарном расширении температура увеличивается, внутренняя энергия увеличивается, ΔU > 0; газ совершает положительную работу, A > 0; Q > 0 – тепло поглощается газом При изобарном сжатии температура уменьшается, внутренняя энергия уменьшается, ΔU > 0; газ совершает отрицательную работу, A < 0; Q < 0 – тепло отдается внешним телам.
Обращаем внимание, что количество теплоты можно рассчитывать либо через изменение температуры, либо через изменение объема при известном давлении газа.
3. В изотермическом процессе температура газа не изменяется, а значит, не изменяется и внутренняя энергия газа, ΔU = 0. Следовательно:
 . (8.12)
. (8.12)
Здесь T – температура изотермического процесса; V 1 p 1 и V2 p 2 – объем и давление в начальном и конечном состоянии газа. Формула (8.12) получена путем расчета работы, как площади криволинейной трапеции на диаграмме (p V) для изотермического процесса.
|
|
|
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Такие процессы называются адиабатическими.
4. В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид:
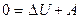 или
или 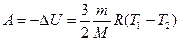 . (8.13)
. (8.13)

При адиабатическом расширении работа газа положительна A > 0, температура газа уменьшается Т 2 < Т 1, внутренняя энергия газа уменьшается, т. е. газ совершает работу за счет убыли его внутренней энергии.
При адиабатическом сжатии работа газа отрицательна A < 0, температура газа увеличивается Т 2> Т 1, внутренняя энергия газа увеличивается, т. е. положительная работа внешних сил, действующих на газ, идет на увеличение внутренней энергии газа.
На диаграмме (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При адиабатическом расширении температура газа уменьшается. Вследствие этого давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом (рис. 8.4).
 2014-02-02
2014-02-02 22932
22932
