Различие в зависимости от природы С-Н радикала
алиф(спирты)
аромат(фенолокислоты)
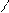 Алифатические О
Алифатические О

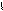 Основные: ** гликолевая (2-гидроксиэтановая) СН2-С
Основные: ** гликолевая (2-гидроксиэтановая) СН2-С
ОН ОН
** молочная (2-гидроксипропановая)
α-оксипропионовая, соли-лактаты)
 СН3-СН-COOH
СН3-СН-COOH
OH
Двухосновные:
** Яблочная (гидроксибутандиовая)
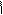 HOOC-CH-CH2-COOH
HOOC-CH-CH2-COOH
CH
** Винная(2,3- дигидроксибутандиовая)

 HOOC-CH-CH-COOH
HOOC-CH-CH-COOH
OH OH
Трехосновные: ** Лимонная (2-гидрокси -1,2,3-пропантрикарб.к-та)
 OH
OH
 HOOC-CH2-C-CH2COOH соли-цитраты.
HOOC-CH2-C-CH2COOH соли-цитраты.
COOH
Способы получения: *Гидролиз Halкарб.к-т(α,β,γ)
*Гидролиз гидроксинитрилов
 O α
O α
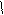

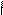

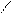
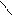 R-C HCN R-CH-CaN H2O R-CH-COOH
R-C HCN R-CH-CaN H2O R-CH-COOH
H OH OH
*Гидратация α,β – непредельных карб.к-т
*Восстановление соответствующих оксо-соединений.
Химические свойства: 1. По – COOHгр.
2. По – OHгр.
Кисл.св-ва: Snреакции (HCl, PCl3,SOCl2, простые, сложные эфиры, окисление)
3. Специфические св-ва:
Отношение к нагреванию позволит определить взаимное расположение этих функц.групп.
** α-гидроксикислоты при нагревании подвергаются межмолекулярной дегидратации с образованием сл.циклических эфиров лактидов.
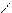 O O
O O
 R – CH - C R-CH-C
R – CH - C R-CH-C
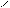
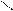
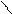
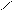
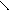
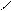 HO OH to O O
HO OH to O O

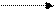 OH HO -2H2O C – CH-R
OH HO -2H2O C – CH-R
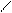
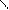
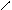

 C-CH O
C-CH O
O R
** β-гидроксикислоты при нагревании отщепляют воду внутримолекулярно с образованием α,β-ненасыщ к-т


 R-CH2 -CH-CH-COOH to R-CH2-CH=CH-COOH
R-CH2 -CH-CH-COOH to R-CH2-CH=CH-COOH



 OH H -H2O
OH H -H2O
** γ-гидроксикислоты при to-также внутримолекулярно с образованием сл.цикл.эфира-лактона.



 H2C-CH2 H2C-CH2
H2C-CH2 H2C-CH2
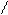
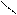


 R-CH C=O to R-CH C=O лактон
R-CH C=O to R-CH C=O лактон
HO OH -H2O O
** расщеплениеα-гидроксикислот.
При toв присутствии H2NO3(к) идет расщепление по С1, С2, связи с образованием карбонильного соед. и муравьиной к-ты, α-ая разлагается дальше.

 O-H O
O-H O

 R-C-COOH to, H2SO4(k) HCOOH + R-C
R-C-COOH to, H2SO4(k) HCOOH + R-C
H CO H2O H
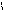 COOH
COOH
CH2 COOH to, H2SO4(k) HCOOH + COOH to CH3










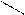
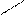 C CO H2O CH2 -2CO2 C=O
C CO H2O CH2 -2CO2 C=O
CH2 OH C=O CH3


 COOH CH2
COOH CH2
COOH
Ацетондикарбоновая к-та.
Ароматические (фенолокислоты)
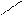
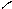
 COOH ортогидроксибензойная к-та.
COOH ортогидроксибензойная к-та.
 Салициловая к-та.
Салициловая к-та.
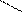
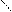 OH
OH
 COOH
COOH



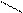

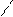 OH галловая к-та.
OH галловая к-та.
 HO OH 3,4,5- тригидроксибензойная к-та.
HO OH 3,4,5- тригидроксибензойная к-та.
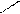


 CH=CH-COOH
CH=CH-COOH
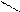
 OH
OH
Получения: **Многие содержатся в свободном сост, или в виде сл.эфиров в растениях.
** Карбоксилирование фенолов(метод Кальбе-Шмиттов)




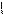

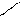
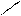
 ONa O O OH OH
ONa O O OH OH
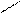



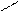
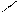


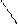
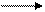




 + Cб+ H COONa +HCl COOH
+ Cб+ H COONa +HCl COOH
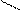
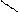
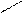

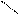
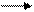
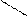
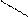 O COONa
O COONa
Химические свойства: 1.по –COOHгр.
2. по –ОН гр.
3. по ароматическому кольцу-согласованная ориентация в реак.SE


 COOH COOH COOH
COOH COOH COOH
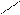


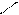

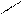






 OH + HNO3(k) H2SO4 (k) OH + OH
OH + HNO3(k) H2SO4 (k) OH + OH
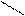
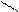

 -H2O NO2 NO2
-H2O NO2 NO2
4. При нагревании легко дикарбоксилтруются
COOH OH





 OH to фенол
OH to фенол
 | |||
 |
 COOH
COOH



 to
to
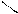
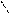
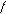
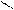
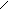
 -CO2
-CO2
 HO OH OH HO OH OH
HO OH OH HO OH OH
 2014-02-02
2014-02-02 859
859








