Схема получения целевого продукта
ТЕХНОЛОГИЧЕСКИЕ ПРИЕМЫ И АППАРАТУРНОЕ ОФОРМЛЕНИЕ ПРОЦЕССОВ ВЫРАЩИВАНИЯ МИКРООРГАНИЗМОВ
1. Общие принципы получения продуктов биотехнологии.
2. Схема получения микробного белка.
3. Схема получения метаболитов медицинского назначения.
В основе типовых схем получения продуктов биотехнологии с использованием микроорганизмов лежат следующие этапы:
1. Выращивание чистой культуры (ЧК) в пробирках (если она в замороженном виде ее оживляют).
2. Получение маточной культуры.
3. Получение посевной культуры для производства (инокулят) в аппарате ЧК.
4. Получение питательных сред: при составлении питательных сред необходимо учитывать потребности микроорганизмов в питательных веществах. Источник углерода – углеводы, реже спирты. Основой питательной среды могут служить отходы различных производств: сусло, гидролизаты древесины (лиственные породы).
5. Ферментация: выращивание в биореакторе (ферментере) либо на кюветах.
6. Выделение необходимого продукта, его очистка, концентрирование и стандартизация. Питательные среды, биореактор, вспомогательное оборудование, воздух, вода повергаются стерилизации:
- термически (острый пар, подаваемый струей под давлением, глухой пар через змеевик)
- химически (дезинфицирующими агентами)
- фильтрационным методом (пропускание газов, питательных сред через мелкопористые или ватные фильтры).
При выделении готового продукта имеет значение, где накопился продукт:
1. продукт может быть биомасса
2. продукт может быть внутри клетки
3. продукт может выделяться в питательную среду
Наиболее сложно, если продукт находится внутри клетки.
Вначале отделяют биомассу от культуральной жидкости (КЖ). Применяется сепарирование, флотация, может фильтрация и центрифугирование.
Если продукт накапливается в клетках, их дезинтегрируют, т.е. разрушают клеточные стенки. Используется ультразвук, вибратор, давление, осмотический шок, вымораживание, т.е. физические методы. Могут применяться химические методы, т.е.обработка антибиотиками, ПАВами. Можно применить комплексный метод.
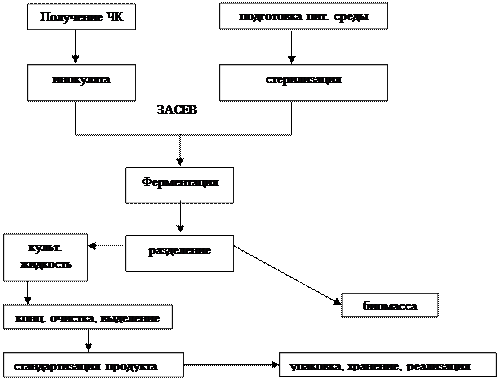 |
Перспективно использование ферментов различных целлюлаз для разрушения КС. Отделение продуктов осуществляют осаждением, регулируя при этом рН, температуру, в качестве осаднителей используют спирты, другие растворители. Используют экстракцию, адсорбцию. Концентрирование продуктов осуществляется путем ультрафильтрации, обратного осмоса, выпариванием. Обезвоживание проводят путем сушки. Стабилизируют. Схематично работу получения продуктов биотехнологии можно представить следующей схемой (см.выше)
2. Наиболее дефицитный компонент пищи – белок (белок одноклеточных получают с помощью микроорганизмов). Процесс получения микробного белка не зависит от климата, не требует больших площадей, поддается автоматической регуляции, что способствует получению стандартного продукта.
Главная характеристика биологической или питательной ценности белка – сбалансированность его аминокислотного состава. Для характеристики этого показателя в качестве эталонного принят аминокислотный состав белка куриного яйца или женского грудного молока, их аминокислотный состав наиболее благоприятен для усвоения.
Питательная ценность белков определяется содержанием незаменимых аминокислот, которые не синтезируются в животном организме: лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин. Для оценки белков по их содержанию используется показатель скора
СКОР= Незаменимая аминокислота/ ∑ незаменимых аминокислот в белке
Этот показатель берется в процентах от соответствующего отношения в эталонном белке. Аминокислота, имеющая наименьший показатель скора называется первой лимитирующей аминокислотой данного продукта. Питательная ценность животных белков близка к эталону, растительных – нет. Белки злаковых дефицитны по содержанию лизина.
Белковые добавки должны соответствовать определенным требованиям:
1. Общее требование: допустимое содержание канцерогенов, токсинов, ионов тяжелых металлов, патогенных микроорганизмов.
2. Специфические требования: ограниченное содержание нуклеиновых кислот. Норма: 2г нуклеиновых кислот в 20-30г высушенной биомассы дрожжей или 10-20г бактерий; ограниченное содержание бактерий, разветвленных жирных кислот, что зависит от условий культивирования; низкое содержание остаточных углеводородов. Микроорганизмы – продуценты не должны вызывать аллергических реакций и обладать патогенными свойствами. Анализу подвергается как сама добавка, так и продукты с ее добавлением.
ПРОЦЕСС ВЫРАЩИВАНИЯ И ПРИНЦИП КОНТРОЛЯ
Белок одноклеточных в производственных масштабах выращивают в биореакторе по принципу хемостата. В среду с развивающимися микроорганизмами подается водный раствор органических соединений и органический субстрат (конкретные для каждого микроорганизма). Культура перемешивается, аэрируется и охлаждается. Если это дрожжи, в последствии их отделяют от водной среды сепарированием, если грибы – фильтрацией; обработка при температуре 70-80°С, после отмирания клеток сметанообразную массу высушивают, гранулируют, упаковывают. Сырье – гидролизаты растительного сырья (мезга подсолнечника, риса, кукурузы, стебли хлопчатника). Можно выращивать: Trichosporon, Candida, Hansenula.
Разрабатывают два направления:
1. использование чистых видов сырья (желательно индивидуальных соединений), что позволит получить продукт постоянного качества.
2. Использование различных отходов, что позволяет бороться с местным загрязнением среды.
3.ПОЛУЧЕНИЕ ВАКЦИН
Вакцины – это продукты, способствующие созданию активного искусственного иммунитета. Получают их из патогенных микроорганизмов и из продуктов их обмена.
Схема процесса традиционная:
1. Работа со штаммами, подготовка среды
2. Накопление биомассы
3. Инактивация нативной микробной взвеси
4. Стандартное разведение
5. Лиофильное высушивание
6. Запаивание ампул
7. Этикетировка
Требования к вакцинам:
1. Стерильность
2. Идентичность
3. Безвредность
4. Стандартность
5. Умеренная реактогенность
6. Иммуногенность
4. Получение антибиотиков:
1. Подготовка среды
2. Работа со штаммами
3. Получение посевного материала
4. Ферментация (биосинтез). Контролируют температуру, рН, количество кислорода и давление, потребление углерода, азота, фосфора.
5. Отделение мицелия
6. Выделение, очистка: на этой стадии важно сохранение свойств антибиотика.
7. Сушка
8. Контроль по интересующему показателю (количество антибиотика и его активность)
9. Расфасовка и этикетировка
1. Иммобилизованные ферменты: виды иммобилизации, задачи, перспективы.
2. Иммобилизованные клетки микроорганизмов.
3. Проточные биореакторы с использованием иммобилизованных ферментов и клеток (ПБР – проточный биореактор).
Иммобилизация позволяет использовать ферменты и клетки в технологических процессах неоднократно, что снижает себестоимость получаемых продуктов.
Иммобилизованные ферменты –это те, у которых полностью или частично ограничено перемещение в пространстве. Для этого ему придают нерастворимую в воде форму.
Виды иммобилизации:
1. Включение в массу капсулирующего материала;
А) включение в матрицу: матрицей служит крахмал или другой полимер. Недостаток: снижение активности,так как снижается доступность фермента к субстрату.
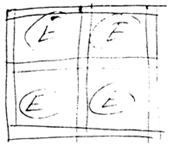
Б) микрокапсулирование. Недостаток: непрочность капсулы.

В) химическое связывание путем адсорбции. Недостаток: непрочное связывание с носителем, сложность подбора носителя.
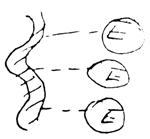
Г) ковалентное связывание с носителем: активность может снизиться за счет связывания некоторых активных групп фермента
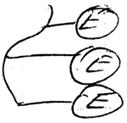
Д) ковалентное связывание с другими ферментами.
ЗАДАЧИ ИММОБИЛИЗАЦИИ
Необходимо сохранить активность ферментов, которая может быть утрачена по ряду причин: денатурация (изменение структурной формы), иноктивация под действием реагентов, блокирование активных центров фермента за счет связывания с носителем. Чем больше молекулярная масса субстрата, тем сильнее снижение активности по отношению к нему, т.к. носитель создает препятствие для подхода крупных молекул субстрата к активным центрам фермента, изменение рН, температуры тоже изменяет активность фермента. Микрокапсулирование используют в медицине. При изготовлении биосенсеров, биодатчиков. В экологии: при очистке сточных вод, для удаления органичесикх отходов и их переработки, для извлечения ионов тяжелых металлов.
Способы иммобилизации клеток микроорганизмов
1. Химические: образование новой связи между активированным носителем и активными группами клеточных стенок микроорганизма.
2. Физические: агрегация, адсорбция. Способствует повышению стабильности и сохранению активности клеток, т.е. сохраняется их нативная (природная) структура. Исключая расходы на очистку и выделение ферментов иммобилизуют как живые (здоровые), так и поврежденные клетки. Живые клетки участвуют в полиферментных реакциях, поврежденные – в одностадийных.
3. Проточные биореакторы (ПБР)
Проточные биореакторы (ПБР) различают по геометрической форме, по размерам, по характеристике протекания процесса во времени, по реологическим свойствам жидкой фазы, по условиям диспергирования и перемешивания сред, по особенностям кинетики ферментных реакций, по биохимическому процессу, который в них осуществляется, по способу иммобилизации ферментов или клеток, по устройству.
По объему различают мини-, макро-, микрореакторы.
По типу и числу ферментов: моноферментные реакторы, полиферментные реакторы, биферментные реакторы.
При конструировании ПБР обязательно учитывается принцип сохранения максимальной активности ферментов и клеток, а также выход целевого продукта реакции. Регулируется массовая доля субстрата, количество фермента, рН, температура, количество кислорода, скорость протока субстрата, вывода продуктов.
 2014-02-02
2014-02-02 4210
4210
