В сельском хозяйстве применяют несколько десятков различных видов минеральных и других удобрений. Все минеральные удобрения классифицируют на:
азотные — аммиачная селитра NН4NОз, аммиачная вода
NН4ОН, мочевина (NН2)2СО и др.;
фосфорные — суперфосфат Са(Н2РО4)2·Н20, трикальцийфосфат Са3(Р04)2, фосфоритная мука и др.;
калийные — калий хлористый КС1, калиевая селитра КNО3 и др.
Применяют также комбинированные удобрения — тукосмеси, аммиачная селитра + суперфосфат, сульфат аммония + суперфосфат, биоминеральные удобрения и др.
Из перечисленных видов минеральных удобрений рассмотрим лишь те, которые представляют пожарную опасность: селитры, амми-
ачную воду, мочевину.
Аммиачная селитра (NН4NО3) — бесцветное кристаллическое вещество, содержащее 60 % кислорода, 5 % водорода и 35 % азота, причем половина азота находится в виде азота аммиака, а половина — в виде азота азотной кислоты. Селитра хорошо растворяется в воде, является сильным окислителем. В интервале температур 145 — 166°С аммиачная селитра плавится, при нагревании выше 300 °С взрывается. Разложение протекает по следующим уравнениям:
2NН4NО3 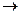 2N2 + О2 + 4H2O
2N2 + О2 + 4H2O
4NН4NО3 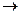 3N2 + 2NО2 + 8H2O
3N2 + 2NО2 + 8H2O
3NН4NО3 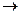 2N2 + N2О3 + 6H2O
2N2 + N2О3 + 6H2O
5NН4NО3 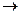 2HNO2 + 4N2 + 9H2O
2HNO2 + 4N2 + 9H2O
Взрывчатые свойства селитры увеличиваются при смешивании ее с органическими веществами и материалами (соломой, древесными опилками стружкой, щепками, жмыхом подсолнечника и т. п.). При повышении тем-
пературы селитра разлагается с выделением кислорода, который увеличивает интенсивность и распространенность пламени. Но даже без добавки горючих примесей аммиачная селитра способна к детонации. Это подтверждается примерами взрывов, происшедших в разных странах мира при попытке разрыхления селитры.
Скорость детонации селитры колеблется от 1500 до 3000 м/с. Объем выделяющихся газов при взрыве составляет 976 л/кг, теплота взрыва 1470 кДж/кг, температура взрыва 1230°С. При влажности выше 2,5% детонационные свойства селитры пропадают. К удару аммиачная селитра нечувствительна, взрывается только при достижении так называемой критической массы.
При обычных температурах хранения и транспортирования внутри массы чистой аммиачной селитры не происходит самовозгорания и, следовательно, термическое разложение ее исключается. В присутствии некоторых веществ как органического, так и неорганического происхождения температура разложения аммиачной селитры значительно снижается. Так, температура разложения аммиачной селитры при добавлении древесной муки составляет 170 °С, серного колчедана 120 °С, а при смешении ее с измельченным цементом (в соотношении 1:1) температура разложения аммиачной селитры понижается до 40 °С вследствие химической реакции между селитрой и гидрооксидом кальция.
Органические вещества при контакте с аммиачной селитрой также изменяют свои пожароопасные свойства.
Смеси аммиачной_селитры с горючими материалами (деревом, соломой, торфом, льном, мешкотарой и др.) склонны к тепловому самовозгоранию, что обусловлено экзотермической реакцией нитрования. За счет теплоты
реакции нитрования при температуре около 100°С начинается автокаталитическое разложение аммиачной селитры, в результате которого органические продукты разогреваются до температуры их самовоспламенения. Автокатализ вызывается главным образом выделяющимися при разложении аммиачной селитры диоксидом азота и в меньшей степени водяным паром. Особенно повышают пожаро- и взрывоопасность аммиачной селитры примеси порошкообразных металлов, которые могут служить сильнейшими катализаторами ее экзотермического разложения.
Калиевая селитра (КNО3) в чистом виде — бесцветное кристаллическое вещество; температура плавления 337°С; при нагревании разлагается
2КNО3 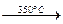 К2О + 2NО2 + О
К2О + 2NО2 + О
4КNО3 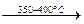 2К2О + 2N2 + 5О2
2К2О + 2N2 + 5О2
При разложении селитры выделяется атомный кислород, вследствие чего она и является сильным окислителем. Калиевая селитра более чувствительна к удару и трению, чем аммиачная. Пожарная опасность калиевой селитры может быть оценена хотя бы по тому показателю, что ее применяют для изготовления порохов и быстрогорящих пиротехнических составов. Способность к взрыву калиевой селитры увеличивается при смешении ее с органическими веществами.
На складах селитр возникший пожар распространяется с большой скоростью, что обусловлено выделением кислорода при разложении солей. Не рекомендуется приближаться вплотную к очагу горения, так как в результате выгорания селитры в массе ее могут образовываться пустоты, заполняемые водой. При нагревании вода превращается в пар, выделение которого аналогично взрыву.
Аммиак жидкий синтетический и аммиак водный технический (аммиачная вода). Аммиак в почве под воздействием жизнедеятельности различных бактерий способствует образованию селитр.
Аммиак жидкий синтетический представляет собой бесцветную жидкость, хорошо растворимую в воде. Температура кипения 33,4°С, теплота испарения 1373 кДж/кг. Жидкий аммиак имеет температуру самовоспламенения 650°С. На воздухе он интенсивно испаряется, образуя с воздухом взрывоопасные смеси. Область воспламенения 15—28% (об.). Давление при взрыве достигает 0,6 МПа. Горит бледно-желтым пламенем. Теплота горения 18690 кДж/кг. При взаимодействии жидкого аммиака с иодом или хлором образуется йодистый или хлористый азот — сильные взрывчатые вещества.
Аммиак водный технический (аммиачная вода) — бесцветная или желтая жидкость с резким запахом аммиака. Представляет собой раствор газообразного аммиака в воде. В растворе его содержится 20—25%, труд-
ногорюч. Однако при нагревании аммиак легко испаряется и образует с воздухом в закрытом объеме взрывоопасные смеси. Температура вспышки 23°С при 25%-ной концентрации аммиака. Температурные пределы воспла-
менения 23—33°С, температура самовоспламенения выше 750 °С. Аммиак образует взрывоопасные смеси с кислородом воздуха и оксидом азота N2О. Области воспламенения: в кислороде 13,5—79%, в оксиде азота N2О
2,2—72%.
Мочевина (карбамид) — диамид угольной кислоты выпускается в виде кристаллов или гранул и относится к азотным удобрениям. В техническом продукте содержится до 0,015% свободного аммиака и до
1% биурета. Биурет — амид аллофановой кислоты, или уреидоформамид. При нагревании его до 160°С выделяется аммиак и получается циануро-
вая кислота.
Mочевина имеет температуру вспышки 182°С, температуру воспламенения 233°С, температуру самовоспламенения 610°С. Дым при горении карбамида содержит токсичные пары. Взвешенная в воздухе пыль карбамида не взрывоопасна. При взаимодействии карбамида с азотной кислотой может образоваться взрывчатый нитрат мочевины.
При длительном хранении навалом в жаркое время года карбамид слеживается и частично разлагается с образованием биурета и аммиака. Это особенно необходимо учитывать в районах с жарким климатом.
В настоящее время все большее распространение получают бактериальные удобрения и их смеси с минеральными удобрениями.
Биоминеральные удобрения — это продукт переработки торфа, бурого угля, лигнина, сланцев бактериями. Химический состав биоминеральных удобрений может быть различным. Наиболее распространенным является следующий состав биоминеральных удобрений: 79% торфа, 5%
каинита, 5% фосфата шлака, 4% известняка, 2% аммиака водного, 3% барды паточной и 2% микробной закваски. Таким образом, биоминеральные удобрения относятся к органо-мннералыто-бактериальным удобрениям. Почти все исходные продукты удобрений являются горючими материалами. Процесс приготовления биоминеральных удобрений является наиболее пожароопасным.
 2014-02-02
2014-02-02 3611
3611