Металлопротеиназы. Большинство этих ферментов содержат атом цинка, который является каталитически активным. В некоторых случаях, цинк может быть заменен другими металлами типа кобальта или никеля без потери активности.
Аспарагиновые протеиназы. Большинство аспарагиновых протеиназ принадлежит семейству пепсина. Оно включает пищеварительные ферменты типа пепсина и химозина, лизосомальный катепсин D и ферменты процессинга типа ренина, некоторые протеазы из грибов (пенициллопепсин, ризопуспепсин, эндотиапепсин).
Второе семейство включает вирусные протеиназы типа протеаз вируса СПИДа (HIV) (ретропепсин). Эти ферменты представляют собой структуры, состоящие из двух гомологичных долей с активным центром, расположенным между этими долями. Каждая доля вносит один остаток аспартата в создаваемую каталитически активную диаду радикалов аспарагиновой кислоты Один аспартат находится в ионизированной форме, в то время как второй ионизируется при рН оптимуме в диапазоне 2-3. Ретропепсины являются мономерными. Это значит, они несут только один каталитический аспартат, и поэтому необходима димеризация для формирования активного фермента.
В желудочно-кишечный тракт белки поступают из двух источников:
- Экзогенные белки — белки пищевых продуктов (70-100 г)
- Э ндогенные белки — белки пищеварительных секретов и слущивающегося эпителия пищеварительного тракта (20-30 г/сут).
Основная часть поступивших в желудочно-кишечной тракт белков переваривается до смеси аминокислот, дипептидов и трипептидов и небольшое количество непереваренного белка выделяется с калом.
 |
Протеолитические ферменты. В желудочно-кишечном тракте под действием протеолити
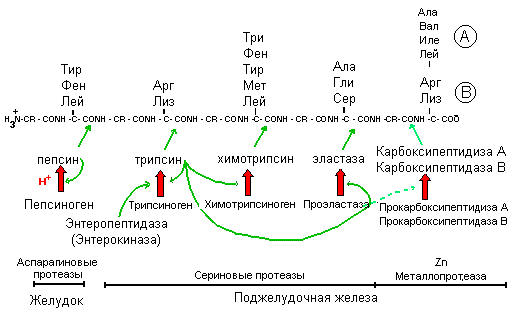
Схема протеолиза пищевых белков в желудочно-кишечном тракте.
ческих ферментов происходит расщепление белков. Они имеют различную специфичность и последовательно гидролизуют белки до аминокислот
Для переваривания белков необходимы:
· Водный раствор с различным значением рН и концентрацией электролитов создает условия, необходимые для оптимальной активности ферментов
· Предшественники ферментов - протеолитические ферменты синтезируются в виде неактивных предшественников (проферментов) и затем активируются в полости желудочно-кишечного тракта. Проферменты активируются путем ограниченного протеолиза.
· Слизь (мукопротеины) – высоковязкие растворы мукопротеинов действуют как смазочные средства, ускоряя прохождение пищи по ЖКТ.
Переваривание белков начинается в желудке.
Секрет клеток слизистой желудка носит название желудочный сок. Это опалесцирующая желтоватая жидкость, содержащая 0.2-0.5% НCl с рН 1.5. В состав желудочного сока входят неорганические соли, ферменты (пепсин, ренин и липаза) и мукопротеины.
Трудно получить продукты секреции париетальных клеток, свободных от загрязнения другими компонентами желудочного сока, но самые чистые образцы, которые были проанализированы представляют изотонические растворы. Их концентрация H + эквивалентна 0.17 N HCl, с pH около 0.87. Поэтому, секрет париетальных клеток можно рассматривать как изотонический раствор практически чистой HCl, которая содержит 150 мэкв Cl- и 150 мэкв Н в литре, хотя pH цитоплазмы париетальных клеток подобно другим клеткам, равен 7.0-7.2, а сопоставимые концентрации Cl- и Н+ на литр плазмы -100 мэкв и 0.00004 мэкв соответственно.
со
 |
ответственно.
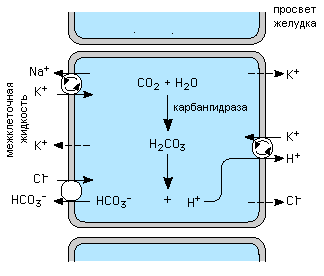
Механизм образования HCl.
 |
Такой большой градиент Н+ поддерживается работой специальной Н+,К+ АТФазы, которая является структурным белком апикальной мембраны париетальных клеток. В покое на поверхности клеток имеется небольшое количество этого фермента, однако под влиянием стимуляторов, большие количества тубовезикулярных структур, которыми богаты париетальные клетки перемещаются к апикальной мембране и сливаясь с ней, увеличивают количество фермента на поверхности и обеспечивают быстрое высвобождение Н+ взамен на К+. Такой обмен требует значительных затрат энергии и обеспечивается гидролизом АТФ.
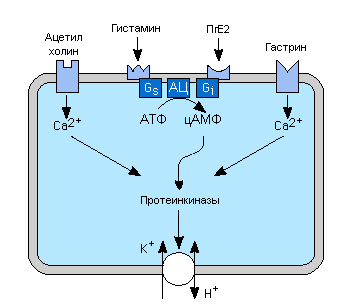
Регуляторы секреции HLl и их вторичные посредники.
Выход Cl- из клеток обеспечивается градиентом электрохимического потенциала через каналы апикальной мембраны, которые активируются цАМФ; Н+ образуется путем диссоциации угольной кислоты, которая в свою очередь образуется в реакции гидратации СО2, катализируемой карбангидразой, ферментом, активность которого в париетальной клетке очень высокая. Второй компонент реакции диссоциации угольной кислоты HCO3- вытесняется из клетки на базолатеральной мембране париетальных клеток взамен на другой анион, главным образом на ион Cl- концентрация которого во внеклеточной жидкости самая высокая. Кровь во время секреции желудка сильно подщелачивается, что приводит в последующем к подщелачиванию мочи.
Секреция соляной кислоты стимулируется гистамином через H2 рецепторы, ацетилхолином через M3 мускариновые рецепторы, и гастрином, вероятно частично через гастриновые рецепторы в мембранах париетальных клеток. H2 рецепторы увеличивают внутриклеточный цАМФ при участии Gs белков, а мускариновые и гастриновые рецепторы проявляют свои эффекты, увеличивая концентрацию внутриклеточного свободного Ca2+. Действие одного из указанных регуляторов обычно потенцируeт ответ другого на возбуждение. Простагландины, особенно E ряда, ингибируют секрецию кислоты, активируя Gi белки, и это объясняет частично повышение риска язвенной болезни у людей, принимающих антивоспалительные препараты, которые ингибируют синтез простагландинов.
Циклическая АМФ и Ca2+ действуют через протеинкиназы, повышая транспорт H+ в желудочный просвет H+-K+ АТФазой.
Hсl понижает рН химуса, поступающего в желудок; денатурирует пищевые белки, создает оптимальный рН для действия пепсина и инициирует ограниченный протеолиз пепсиногена.
Пепсиноген — профермент пепсина с молекулярной массой 40 кД. Его активирование начинается обычно при участии Н+ и затем продолжается аутокатализом активными молекулами пепсина. В процессе активирования происходит удаление нескольких пептидов от N конца (42 аминокислоты), что снижает изоэлектрическую точку с рН 3.7 (пепсиноген) до
1.0 (пепсин). Пепсин в активном центре содержит остатки АСП, катализирует гидролиз внутренних пептидных связей (эндопептидаза) и обладает широкой специфичностью, преимущественно действуя на пептидные связи, образованные карбоксильными группами ароматических и больших алифатических аминокислот с образованием больших пептидных фрагментов.
 2014-02-18
2014-02-18 1021
1021








