Давление P, объем V и температура T не являются независимыми величинами.
Определение 1.
Соотношение, связывающее давление, температуру и объём, называется уравнением состояния газа, то есть, f (P, V, T) = 0.
Найдем уравнение состояния идеального газа.
Ранее указывалось, что 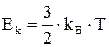 . Подставляя это соотношение в формулу для давления, получаем уравнение состояния
. Подставляя это соотношение в формулу для давления, получаем уравнение состояния
PV = N·kБ·T. (1)
Определение2.
Объём,приходящийся на единицу вещества, называется – МОЛЬ. В 1 моле любого вещества содержится одинаковое число молекул, называемое числомАВОГАДРО – NA=6·1023 молекул.
Число молекул в объеме газа можно записать в виде: N =n ·NA, где n— число молей данного вещества в указанном объеме.
Теперь уравнение (1) запишется в виде:
P·V=n·R·T, (2)
где величина R = kБ·NA называется газовой постоянной.
Примечание. Физический смысл газовой постоянной состоит в том, что она численно равна работе, совершенной 1 молем газа при его нагревании на 1 К при постоянном давлении.
______________________________________________________________________________
Действительно, пусть при нагревании газа на 1 К объем, занимаемый 1 молем газа, изменился при неизменном давлении на ΔV. Представляя давление газа в виде P = F/S, а объем сосуда в виде ΔV =S · h, видим, что величина P · ΔV = F·h есть работа, произведенная газом при его расширении, газовой постоянная численно равна работе, совершенной 1 молем газа при его нагревании на 1 К при постоянном давлении.
|
|
|
 2014-02-18
2014-02-18 659
659







