а) Диссоциация сильного основания (LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2) протекает практически полностью:
 NaOH
NaOH  Na+ + OH– (сильное основание - сильный электролит)
Na+ + OH– (сильное основание - сильный электролит)
Можно считать, что: [ОH-] = Сщел, где Сщел - молярная концентрация сильного основания (щелочи). Расчет рН раствора сильного основания проводят по схеме: рОН = - lg а ОН- = - lg f ОН-[ОH-]; рН = 14 – рОН.
б) Диссоциация слабого основания протекает незначительно, частично:
 NH3∙H2O
NH3∙H2O  NH4+ + OH– (слабое основание - слабый электролит)
NH4+ + OH– (слабое основание - слабый электролит)
Молярную концентрацию гидроксид – ионов [ОH-] в растворе слабого основания рассчитывают по закону разведения Оствальда:
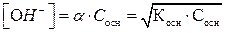 , где α – степень диссоциации основания, Сосн –
, где α – степень диссоциации основания, Сосн –
молярная концентрация основания, Косн – константа диссоциации основания, характеризует силу основания: чем меньше константа диссоциации, тем слабее основание.
 2014-02-24
2014-02-24 482
482








