Состав воздуха в приземном слое
Состав атмосферы
Атмосфера представляет собой чрезвычайно сложную систему. Ее пронизывает излучение Солнца и испускаемые им частицы высокой энергии, а также космическое излучение. Этот поток энергии оказывает заметное химическое воздействие на атмосферу. Кроме того, под воздействием земного притяжения более тяжелые атомы и молекулы опускаются в нижнюю часть атмосферы, а в верхней ее части остаются более легкие. В результате состав атмосферы оказывается непостоянным.
Состав атмосферы в приземном слое, например, состав сухого воздуха вблизи уровня моря обладает следующими характеристиками: примерно 99% всего состава приходится на долю двухатомных газов азота и кислорода, а все остальное, за исключением углекислого газа, - на долю одноатомных газов (табл. 7.1).
Таблица 7.1
| Компонент | Содержание в мольных % | Молярная масса |
| Азот N2 | 78,04 | 8,013 |
| Кислород O2 | 20,948 | 1,998 |
| Аргон Ar | 0,934 | 9,948 |
| Диоксид углерода CO2 | 0,033 | 4,009 |
| Неон Ne | 0,001818 | 0,183 |
| Гелий He | 0,000524 | 0,003 |
| Метан CH4 | 0,0002 | 6,043 |
| Криптон Kr | 0,000114 | 3,800 |
| Водород H2 | 0,00005 | 0,0159 |
| Оксид азота (1) N2O | 0,00005 | 4,013 |
| Ксенон Xe | 0,0000087 | 31,300 |
Примечание. Озон O3, диоксид серы SO2, оксид азота NO2, аммиак NH3, оксид углерода СО присутствуют в качестве примесей, и их содержание может меняться.
|
|
|
Хотя на верхние зоны атмосферы приходится лишь небольшая часть ее массы, эти верхние слои в значительной мере определяют жизнь на поверхности Земли. Они защищают нашу планету от потока лучей и града частиц высоких энергий. В результате такого воздействия молекулы и атомы подвергаются химическим превращениям. Диффузное разделение (более тяжелые внизу, более легкие наверху) за длительный период привело к тому, что на высоте 500 - 1000 км элемент гелий становится основным компонентом атмосферы. Гелиевая корона Земли простирается примерно до 1600 км, а выше 2000 -3000 км преобладает водород.
Солнце испускает энергию с разной длиной волны. Коротковолновое излучение в ультрафиолетовой области спектра обладает высокой энергией, вызывающей химические реакции. При этом энергия фотона (Е = hn) должна быть достаточна для разрыва химической связи в молекуле и инициирования процесса. Кроме того, молекулы должны поглощать фотон, энергия которого должна превращаться в какую-либо иную форму. Первая реакция - фотодиссоциация кислорода:
О2 (г) + hn ® 2 О (г) (1)
Максимальная энергия, которая необходима для такого превращения, равна 495 кДж/моль. Можно выполнить нетрудный расчет (см. ниже задачу) и определить, каковы должны быть n и l этого излучения. l равна 242 нм. Значит, любой фотон с длиной волны менее 242 нм имеет достаточную энергию для этой реакции (чем короче l, тем выше энергия).
|
|
|
Задача. Какая длина волны фотона соответствует молярной энергии диссоциации связи 495 кДж/моль?
Решение. Сначала вычислим энергию, необходимую для разрыва связи в одной молекуле.
Е` = 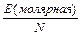 =
= 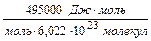 = 8,22·10–19
= 8,22·10–19 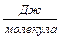 .
.
Найдем частоту колебания, зная, что энергия фотона Е = hn;
n =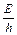 =
= 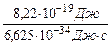 = 1,24·1015 с-1.
= 1,24·1015 с-1.
Вспомним, что произведение частоты и длины волны электромагнитного излучения равно скорости света: n·l = с = 3,00·108 м/с;
l = 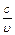 = =
= = 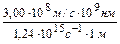 = 242 нм.
= 242 нм.
К нашему счастью, молекулы О2 поглощают большую часть коротковолнового излучения с высокой энергией, прежде чем оно достигнет нижней части атмосферы. При этом образуется атомарный кислород. На высотах около 400 км диссоциировано 99% молекул кислорода, на долю молекул О2 приходится лишь 1%. На высоте 130 км содержание О2 и О одинаково. На меньших высотах содержание молекулярного кислорода больше такового атомарного.
Энергия диссоциации молекулы N2 очень велика, значит, разорвать молекулу могут только фотоны с чрезвычайно высокой энергией и очень малой l. Таких фотонов немного, да и молекула азота плохо поглощает фотоны, даже если их энергия окажется достаточной. Вследствие этого атомарного азота очень мало.
Фотодиссоциация воды. Концентрация паров воды значительна вблизи поверхности Земли, но быстро уменьшается с высотой. На высоте 30 км (стратосфера) составляет три молекулы на миллион молекул смеси. Однако, оказавшись в верхних слоях, вода подвергается фотодиссоциации:
Н2О(г) + hn ® Н (г) + ОН(г); (2)
ОН (г) + hn ® Н (г) + О(г). (3)
Фотодиссоциация (уравнения 1-3) осуществляется через процесс ионизации. В 1924 году было установлено, что в верхних слоях атмосферы имеются свободные электроны, а по закону баланса зарядов должны быть и положительно заряженные ионы. Откуда же берутся эти ионы? В меньшей мере от воздействия электронов, прилетающих от Солнца вместе с солнечным ветром, а в большей мере - вследствие фотодиссоциации. При воздействии фотона молекула может поглотить его, не расщепляясь на атомы. При этом фотон выбивает из молекулы электрон самого верхнего уровня, и образуется молекулярный ион. Таким же образом может подвергнуться ионизации и нейтральный атом.
Фотоны, вызывающие ионизацию, относятся к высокочастотной коротковолновой области в пределах ультрафиолета. Это излучение не доходит до поверхности Земли, его поглощают верхние слои атмосферы (табл. 7.2).
Таблица 7.2
 2014-02-09
2014-02-09 1889
1889








