Условие, в котором находится электрон в атоме, называют электронным состоянием. Это состояние определяется набором четырех квантовых чисел: n, l, ml и m s. Их называют: n – главное квантовое число, l – орбитальное квантовое число, ml – магнитное квантовое число (или магнитно-орбитальное квантовое число), ms – магнитно-спиновое квантовое число. Введение этих квантовых чисел обусловлено тем, что электрон атома, находясь в определенном состоянии, характеризуется определенными значениями энергии, орбитальным и спиновым моментами импульса, орбитальным и спиновым магнитными моментами и проекциями этих величин на направление магнитного поля. Квантовые числа могут принимать следующие значения:
n – 1, 2, 3, …, ∞;
при заданном значении n, l может принимать только следующие значения:
l – 0, 1, 2, 3, … n -1;
при заданном значении l, ml может принимать только следующие значения:
ml - l, - l + 1, - l + 2, - l + 3, … 0, 1, 2, 3, … l (2 l + 1) – значение;
ms - ± 1/2 (только два значения).
Согласно принципу Паули в атоме не может быть двух электронов, находящихся в одинаковом состоянии, или в атоме не может быть двух электронов характеризующихся одинаковым набором четырех квантовых чисел.
|
|
|
Для энергетической характеристики свободных атомов (атомов, на которые не действуют внешнее поле) электронные состояния этих атомов принято обозначать с помощью квантовых чисел n и l. При этом квантовые числа n обозначают цифрами, а l – буквами в следующем соответствии:
l – 0, 1, 2, 3, … n -1;
s, p, d, f, …
У электронов атома возможны следующие электронные состояния:
1 s
2 s 2 p
3 s 3 p 3 d
4 s 4 p 4 d 4 f
- - - -
Схема возможных энергетических уровней электронов в атоме приведена на рис. 11.1.
| 2 p | n | l | ml | ms |
| 1/2 | ||||
| -1/2 | ||||
| 1/2 | ||||
| -1/2 | ||||
| -1 | 1/2 | |||
| -1 | -1/2 |
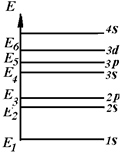 Каждый из указанных уровней включает в себя 2(2 l + 1) состояний. Например, уровень энергии 2 p включает в себя 6 состояний с указанным в таблице набором квантовых чисел.
Каждый из указанных уровней включает в себя 2(2 l + 1) состояний. Например, уровень энергии 2 p включает в себя 6 состояний с указанным в таблице набором квантовых чисел.
В свободном атоме, электроны,
подчиняясь принципу Паули, занимают прежде всего свободные состояния с минимально возможной энергией. Например, у атомов меди (Cu, z= 29) электроны следующим образом распределены по электронным состояниям:
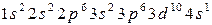 .
.
Записанное выражение называют электронной конфигурацией атома, которая указывает на структуру распределения электронов по оболочкам и подоболочкам. Электроны с одинаковым значение n образуют оболочку атома. Различают следующие оболочки:
n 1 2 3 4 …
Число электронов
в оболочке (2n2) 2 8 18 32
Условное
обозначение K L M L
Электроны, которые характеризуются одинаковыми значениями n и l образуют подоболочку. Число электронов в подоболочке равно 2(2 l + 1). Итак, у атома Cu, находящегося в свободном состоянии, электроны заполнили полностью K, L, и M оболочки, внешний (валентный) электрон находится в состоянии 4 s. Если возбудить атом (сообщить ему незначительное количество энергии), то изменит свою энергию прежде всего внешний электрон, перейдя, например, в состояние 4 p и электронная конфигурация у атома примет выражение: 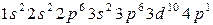 . Для вывода электронов из полностью заполненных оболочек потребуется сообщить атому значительную долю энергии (используя, например, рентгеновское или гамма излучение).
. Для вывода электронов из полностью заполненных оболочек потребуется сообщить атому значительную долю энергии (используя, например, рентгеновское или гамма излучение).
|
|
|
 2014-02-09
2014-02-09 1217
1217








