Напишем уравнения диссоциации угольной кислоты
Рассчитать pH 0,1 М раствора серной кислоты.
Решение:
H2SO4 ® 2H+ + SO42–,
C(H+) = 2C(H2SO4) = 0,1·2 = 0,2 моль/л,
рH = – lg[H+] = – lg 2 ·10-1= – lg 2 – lg 10-1= -0,3 + 1 = 0,7.
2) Рассчитать pH в 0,1М растворе Н2СО3.
Решение:
Н2СО3 = Н+ + НСО3- Кд1 = 5·10-7,
НСО3- = Н+ = СО32- Кд2 = 5 ·10-11.
[H+] = 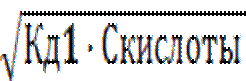 =
= 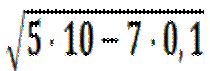 = 2,2·10-4 моль/л.
= 2,2·10-4 моль/л.
Отсюда, рН = -lg 2,2·10-4 = -0,34 + 4 = 3,64.
4 Буферные растворы
Буферные растворы – это растворы при добавлении к которым кислот или щелочей их pH меняется незначительно.
Буферными свойствами обладают:
1) Растворы слабых кислот и их солей. Например, СН3СООН + СН3СООNа – ацетатный буферный раствор.
2) Растворы слабых оснований и их солей. Например, NН4ОН + NН4Сl – аммонийный буферный раствор.
3) Растворы кислых солей слабых кислот. Например, NаН2РО4.
ЛЕКЦИЯ № 6
«ИОННО-ОБМЕННЫЕ РЕАКЦИИ.
ГИДРОЛИЗ СОЛЕЙ»
1 Необратимые ионно–обменые реакции
Ионно-обменные реакции – это реакции обмена между ионами в результате которого образуются слабый электролит, осадок, газ или комплексное соединение.
Примеры ионно-обменных реакций:
1) Образование слабого электролита
NaF + HCl ® HF+ NaCl – молекулярное уравнение,
Na+ + F– + H+ + Cl- ® HF + Na+ + Cl– – полное ионное уравнение,
F– + H+ ® HF – сокращенное ионное уравнение.
 2014-02-09
2014-02-09 1647
1647








