Строение, функции и классификация ферментов
Важнейшую роль в обмене веществ и трансформации энергии в клетке играют биологические катализаторы белковой природы - ферменты.
Все ферменты по своей химической природе разделяются на два больших класса:
· однокомпонентные
· двухкомпонентные.
Первые состоят исключительно из белка. В молекуле вторых кроме белка имеется небелковая часть. Белковая часть двухкомпонентного фермента носит название апоферменmа, а небелковая - коферменmа. В качестве коферментов выступают, прежде всего, витамины В1, В2 и их различные производные, витамин В6, никотиновая кислота и др., а также металлы (железо, медь, кобальт, марганец и др.).
По месту расположения ферменты делятся на три группы:
· эндоферменmы. Действуют в клетке, где образовались;
· экmоферменmы. Участвуют в процессах на цитоплазматической мембране;
· экзоферменmы. Синтезируются в клетке, выделяются из нее и осуществляют свою работу вне цитоплазматической мембраны, снаружи от нее.
|
|
|
Высшим растениям более всего присущи ферменты первой группы. Так, ферменты фотосинтеза расположены в хлоропластах, дыхания - в митохондриях и т.д.
Ферменты второй и третьей групп особенно большое распространение получили в мире микроорганизмов. Они действуют главным образом в субстрате, на котором поселяются микробы. Поэтому их нередко называют внеклеточными ферментами. Однако и у высших растений наблюдается выделение ферментов из клеток, например из корня - в прикорневую зону (ризосферу) или из щитка зародыша злаков - в эндосперм. Выделению ферментов клетками корней нередко способствуют неблагоприятные внешние условия (анаэробиоз и др.).
Ферменты отличаются следующими общими особенностями:
· большой каталитической активностью, значительно более высокой, чем у неорганических катализаторов (напомним, что катализ - это явление изменения скорости химической реакции или ее возбуждения с помощью катализаторов, химический состав которых и их количество после реакции остаются неизменными);
· специфичностью действия, под которой понимается способность фермента реагировать только с определенными веществами (субстратами) и действовать только на определенные химические связи; иначе эту особенность называют субстратной специфичностью фермента;
· лабильностью, т.е. способностью изменять скорость реакции в зависимости от действия ряда внешних и внутренних условий;
· обратимостью действия - способностью катализировать взаимопротивоположную направленность хода реакции; эта особенность присуща далеко не всем ферментам.
|
|
|
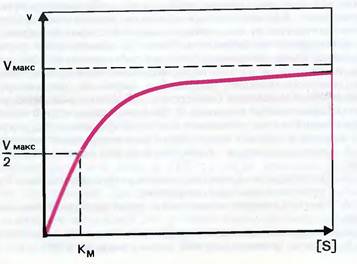
Важной характеристикой любого фермента является константа Михаэлиса. Под этой константой понимается такая концентрация субстрата, при которой скорость ферментативной реакции составляет половину от возможно максимальной концентрации. При малых количествах субстрата скорость ферментативной реакции пропорциональна его концентрации. С возрастанием концентрации субстрата ход реакции ускоряется все в меньшей и меньшей степени, а затем становится независимой от нее (выход кривой на плато) и будет уже определяться концентрацией фермента.
В живой клетке наряду с химической энергией (АТФ) имеется и другой источник унифицированной энергии - физическая (электрическая), которая носит название мембранного потенциала. Он представляет собой разность электрических потенциалов между цитоплазмой клетки и внеклеточной жидкостью.
По современным представлениям, химическая реакция может произойти только тогда, когда молекулы реагирующих веществ будут активированы, т.е. будут иметь определенное дополнительное количество энергии. Без катализатора таких активированных молекул немного и реакции протекают очень медленно. При добавлении катализатора энергия активации, при которой начинается реакция, понижается, а число молекул, которые способны вступить в реакцию, увеличивается. Вместе с этим возрастает и число столкновений молекул между собой, скорость реакции увеличивается. Катализатор снижает энергию активации за счет обходных, дополнительных путей, через ряд промежуточных процессов, требующих меньшее количество энергии. Ниже приводится иллюстрация сказанному.
Реакция распада вещества АВ на А и В без катализатора записывается так:
AВ → A + B.
С катализатором (К) та же реакция будет проходить в несколько этапов:
1)AВ+K → AВK; 2)AВK → BK+A; 3)BK → B+К.
Катализатор снова регенерируется в неизменном виде, а промежуточные реакции, проходя с меньшей затратой энергии, идут быстро, и, следовательно, скорость суммарной реакции АВ → А + В значительно возрастает.
Во взаимодействие с субстратом вступает часть молекулы фермента, получившая название активного центра. Фермент несколько деформирует молекулу субстрата с образованием фермент-субстратного комплекса. Эта деформация ослабляет внутримолекулярные связи в субстрате и делает его молекулу способной вступать в реакцию. На активный центр фермента сильное влияние оказывают специфические активаторы и ингибиторы, ускоряющие или замедляющие его действие. Есть также ингибиторы и активаторы, присоединяющиеся не к активному центру фермента, а к другой его части. При этом изменяется структура молекулы в результате вращения атомов или групп атомов вокруг простых связей, а следовательно, и структура активного центра. В результате этих конформационных перестроек происходит ослабление или усиление активности фермента. Участок молекулы фермента, к которому присоединяются ингибиторы или активаторы (эффекторы), вызывающие изменение структуры активного центра, носит название аллостерического центра.
На скорость ферментативных реакций наиболее сильное влияние из внешних факторов оказывают температура и рН среды.
С повышением температуры до определенных значений скорость ферментативной реакции возрастает, затем, достигнув максимальной величины, начинает падать, для большинства ферментов это 40 - 50° С. Начиная с 50° С и выше скорость ферментативной реакции снижается из-за потери активности фермента вследствие нарушения структуры белка, его денатурации. При этом восстановление активности с наступлением в последующем оптимальной температуры не происходит в отличие от действия пониженных температур, когда перенесение тканей в условия с благоприятной температурой восстанавливает свойственную ферментам активность. Сопоставление скоростей ферментативных и химических реакций при изменении температуры показывает - до момента достижения максимальной скорости работы фермента зависимость скорости химической реакции одинакова с ферментативной, а затем первая продолжает повышаться, в то время как ферментативная из-за денатурации белка ферментов резко падает.
|
|
|
Большинство ферментов полностью инактивируется при температуре 60° С. Встречаются и довольно устойчивые ферменты, например рибонуклеаза или пероксидаза хрена. После промораживания активность ферментов восстанавливается, поэтому в замороженном состоянии можно достаточно долго хранить ферменты вне клетки. В целом белки-ферменты более устойчивы к температуре, чем структурные белки цитоплазмы.
Значительная часть ферментов действует с наибольшей скоростью при реакции среды слабокислой или близкой к нейтральной. Вместе с тем, почти каждый фермент имеет свои кардинальные точки рН среды. Поэтому кислотность внутри клетки является одним из важнейших регуляторов обмена веществ.
На скорость ферментативных реакций оказывают также влияние концентрация ионов, окислительно-восстановительный потенциал и другие факторы.
В природе существует огромное количество не только отдельных ферментов, но и ферментных систем. Список ферментов 1972 г. уже содержал более 2000 наименований. Примерно двести из них получены в кристаллическом виде. Для сотен из них выяснены различные структуры. Для каждого фермента определено название, исходя из его основной функции, и присвоены кодовые числа и шифры. Шифр каждого фермента содержит четыре числа, разделенных точками, и составлен по следующему принципу: первое число указывает класс фермента, второе - подкласс, третье - подподкласс, четвертое - порядок фермента в подподклассе.
В основу классификации ферментов положена природа химических превращений, тип реакций, катализируемых ферментами. По этим признакам все многообразие ферментов раздельно на шесть классов: оксидоредуктазы (окислительно- восстановительные ферменты); трансферазы; гидролазы (гидролитические ферменты); лиазы; изомеразы; лигазы (синтетазы).
|
|
|
К оксидоредyктазам относятся ферменты, катализирующие реакции окисления и восстановления. Они переносят протон или электрон от одного субстрата к другому, окисляя первый и восстанавливая второй. Эти ферменты участвуют во всех процессах биологического окисления - дыхания и брожения.
Из этого класса ферментов особо следует выделить дегидрогеназы, катализирующие реакции отщепления водорода от одного вещества и перенос его к другому. Первое вещество в данном случае называется донором водорода, а второе - акцептором его. Дегидрогеназы разделяют на флавиновые и пиридиновые.
Пиридиновые дегидрогеназы. Их называют анаэробными, так как они непосредственно кислороду передавать водород не могут.
Коферментами пиридиновых дегидрогеназ являются никотинамидадениндинуклеотид-фосфат (НАДФ) и никотинамидадениндинуклеотид (НАД). НАД представляет собой динуклеотид, состоящий из азотистого основания аденина, амида никотиновой кислоты (витамина РР), двух молекул сахара рибозы и двух остатков фосфорной кислоты. НАДФ отличается от НАД присутствием третьего остатка фосфорной кислоты. Со своим апоферментом они связаны только в момент осуществления реакции дегидрирования. Одни дегидрогеназы содержат только НАДФ, другие - НАД, т.е. эти коферменты не могут замещать друг друга.
Взаимодействуя с субстратом, дегидрогеназы отнимают от него два иона водорода и два электрона. Способностью обратимо присоединять протоны и электроны обладают их коферменты. Например, НАДФ переходит в восстановленную форму НАДФН2, НАД - в НАДН2. Примерами анаэробных дегидрогеназ являются малатдегидрогеназа, катализирующая превращение яблочной кислоты в щавелевоуксусную, и алкогольдегидрогеназа, превращающая этиловый спирт (этанол) в уксусный альдегид.
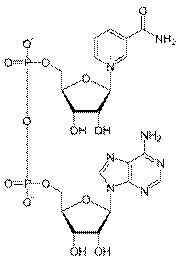
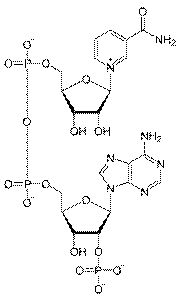
НАД НАДФ
Флавиновые дегидрогеназы. Их называют еще аэробными дегдрогеназами, ибо они могут передавать отнятый от донора водород кислороду воздуха.
Коферментами флавuновых дегидрогенах являются флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН).ФАД и ФМН являются нуклеотидами, содержащими пятиуглеродный спирт D-рибит (рибитол) и азотистое основание рибофлавин (витамин В2), обладающий способностью обратимого при соединения водорода. В составе ФАД находятся два нуклеотида, один из которых содержит остатки D - рибита, фосфорной кислоты и флавина, другой - остатки аденина, рибозы и фосфорной кислоты. Состав ФМН представлен D - рибитом, остатком фосфорной кислоты и флавином. Восстановленная форма ФАД обозначается как ФАД Н2, а ФМН – ФМН Н2. Со своим апоферментом флавиновые коферменты связаны значительно прочнее, чем пиридиновые. Другим отличием флавиновых дегидрогеназ является наличие в составе их апоферментов металлов (железа, марганца, меди, молибдена).
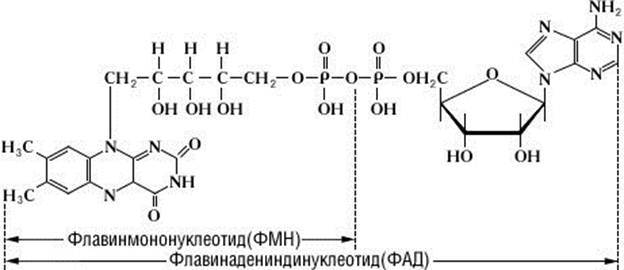
Представителями аэробных дегидрогеназ являются оксидазы, для которых акцептором водорода служит исключительно кислород воздуха. Отщепляя водород от окисляемого вещества АН2 и передавая его кислороду, оксидаза образует воду или перекись водорода. Среди оксидаз в растительном мире широкое распространение получили полифенолоксидаза и аскорбатоксидаза. Обе представлены белком, содержащим в качестве кофермента медь. Первая окисляет дифенолы, вторая превращает аскорбиновую кислоту в дегидроаскорбиновую. Важную роль в жизни растений выполняет цuтохромоксидаза, которая активирует молекулярный кислород, перенося на него электроны от цитохромной системы.
Нельзя не отметить и пероксидазу, осуществляющую окисление органических веществ с помощью перекиси водорода, с которой она образует комплексное соединение и приобретает способность быть акцептором водорода. Пероксидаза широко распространена в мире растений и играет важную роль в превращении полифенолов и ароматических аминов.
К классу оксидоредуктаз относят и фермент каталазу, осуществляющую расщепление перекиси водорода на воду и молекулярный кислород. Физиологическая роль каталазы состоит, прежде всего, в том, что она предотвращает накопление значительных количеств перекиси водорода, так как последняя ядовита для клеток.
Трансферазы - ферменты, катализирующие реакции переноса химических групп между молекулами веществ: метильные (метилтрансферазы), аминные (амuнотрансферазы), фосфатные (фосфотрансферазы) и многие другие. Фосфотрансферазы, для которых донором фосфатных групп служит АТФ, называются киназами.
Гидролазы катализируют реакции гидролитического, т.е. с участием воды, распада веществ. Этот класс делится на подклассы:
· эстеразы - ферменты, расщепляющие сложные эфиры (липазы, фосфатазы и др.);
· карбогидразы - катализируют реакции гидролиза сложных углеводов (амилаза, мальтаза, сахара за и др.);
· пептидогидролдазы (протеазы или пептидазы) участвуют в расщеплении пептидной связи в белках.
Лиазы - ферменты, катализирующие реакции расщепления веществ без участия воды, т.е. негидролитическим путем, а также присоединения функциональных групп по двойным связям. Так, например, фермент пируватдекарбоксилаза отщепляет молекулу углекислоты от пировиноградной кислоты с образованием уксусного альдегида.
Ферменты, катализирующие процессы изомеризации, - изомеразы осуществляют реакции превращения веществ в их изомеры. Например, рибозофосфатизомераза превращает рибозо-5-фосфат в рибулозо-5-фосфат; триозофосфат-изомераза осуществляет превращение фосфоглицеринового альдегида в диоксиацетонфосфат.
Лигазы, или синтетазы, осуществляют реакции синтеза разнообразных веществ. Известно, что все синтетические процессы требуют затраты энергии и поэтому протекают только при участии АТФ. Например, пируваmкарбоксилаза осуществляет реакцию синтеза щавелевоуксусной кислоты из пировиноградной кислоты и СО2.
В данном классе следует отметить и ферменты, участвующие в реакциях присоединения остатков аминокислот к транспортной РНК в процессе синтеза белка. Так, под действием аланил-тРНК-синтетазы образуется комплекс аланина и тРНК.
3 Биосинтез белка в клетке
Во всех живых клетках белки синтезируются на рибосомах. Рибосомы представляют собой крупный рибонуклеопротеидный комплекс с молекулярной массой около 2,5 мДа, состоящий из рибосомных белков, молекул рРНК и ассоциированных с ними факторов трансляции. В состав рибосом входит множество молекул различных белков и несколько молекул рРНК. Полная работающая рибосома состоит из двух неравных субъединиц. Малая субъединица имеет палочковидную форму с несколькими выступами. Большая субьединица похожа на полусферу с тремя торчащими выступами. При объединении в рибосому малая субъединица ложится одним концом на один из выступов большой субъединицы. В состав малой субъединицы входит одна молекула РНК, в состав большой - три.
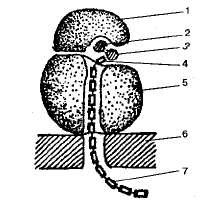
Схема строения рибосомы: 1 - малая субъединица; 2 - иРНК; 3 - тРИК; 4 - аминокислота; 5 - большая субьединица; 6 - мембрана эндоплазматической сети; 7 - синтезируемая полипептидная цепь.
Ниже приведена упрощенная схема биосинтеза белка. Программа, задающая порядок чередования аминокислот в синтезируемом белке, находится в ДНК. Отдельные участки ДНК, называемые генами, являются матрицами для синтеза на них однотяжевых цепей РНК. Синтезированные РНК комплементарны одной из цепей ДНК. Такой процесс копирования гена осуществляется ферментом РНК-полимеразой и называется транскрипцией. В течение синтеза и особенно после него РНК подвергается ряду дополнительных изменений - процессингу, в результате чего формируется информационная или «мессинджер» РНК (иРНК или мРНК). Такая РНК является программой аминокислотной последовательности синтезируемого белка.
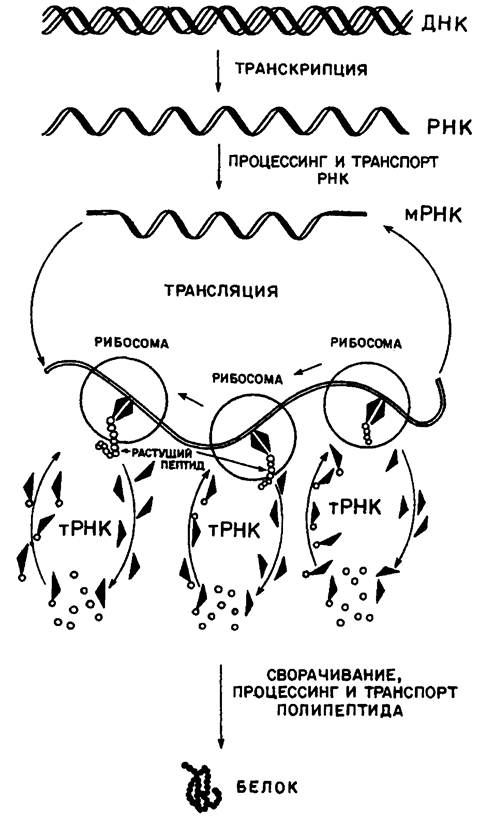
Схема биосинтеза белка
Между кодоном и антикодоном в результате их комплементарного взаимодействия возникают водородные связи. Молекулы же аминокислот с помощью особых ферментов аминоацил-тРНК-синтетаз, факторов инициации (начала), удлинения (элонгация) собираются в строго определенную последовательность образующегося белка. Очередная молекула аминокислоты отрывается от тРНК, а участок иРНК с еще прикрепленной к ней тРНК выходит из рибосомы, тРНК освобождается и вновь может принять участие в процессах трансляции. Рибосома, передвигаясь на три нуклеотида (транслокация), захватывает новые комплексы тРНК с подвешенными к ним соответствующими аминокислотами, и цепь белка удлиняется.
Следует подчеркнуть, что биосинтез белка сложнейший процесс и здесь дана лишь весьма упрощенная его схема. Так, например, необходимо было бы указать, что на первом этапе реализации генетической информации (синтез иРНК) фермент РНК полимераза «узнает» сигнал начала транскрипции - промотор (участок ДНК) и, присоединяясь к нему, расплетает двойную полинуклеотидную цепочку ДНК и с этого момента копирует ее в образующейся цепочке молекулы иРНК в соответствии с принципом комплементарности. Далее по мере передвижения фермента растущая цепь иРНК отходит от молекулы ДНК, как от матрицы, а двойная цепочка ДНК восстанавливается. После достижения ферментом конца копируемого участка (терминатора) иРНК отделяется от матрицы. Известно, что у онкогенных вирусов открыта обратная транскрипция, т.е. перенос наследственной информации с РНК вируса на ДНК хозяина. Участок ДНК, транскрипция которого осуществляется на одну молекулу иРНК, носит название оперона. Он может включать один или несколько генов, содержит регуляторные элементы, такие как промотор (участок начала процесса транскрипции), оператор, с которым связан репрессор (белок, подавляющий транскрипцию), терминатор (сигнал к прекращению процесса транскрипции). Терминатор находится в самом конце оперона. С помощью особых продуктов метаболизма - эффекторов скорость биосинтеза иРНК может повышаться или снижаться. Не менее сложна совокупность реакций, носящих название трансляции.
Следует отметить следующие свойства генетического кода:
· триплетность - каждая аминокислота кодируется тройкой нуклеотидов;
· вырожденность, ибо многие аминокислоты кодируются несколькими кодонами;
· однозначность, т.е. каждый отдельный кодон кодирует только одну аминокислоту;
· неперекрываемость (кодоны одного гена не перекрываются);
· компактность (в молекуле иРНК между кодонами нет нуклеотидов, не входящих в последовательность кодонов данного гена).
Таким образом, нуклеиновые кислоты принимают непосредственное участие в биосинтезе молекул белков. Этот сложнейший биохимический процесс делится на четыре основных этапа:
1. Образование информационной РНК.
2. Активирование аминокислот при участии АТФ с образованием комплекса аминокислоты с аденозинмонофосфатом.
3. Взаимодействие активированных аминокислот с транспортными РНК.
4. Сборка молекул белков путем образования пептидных связей.
Генетическая информация от ДНК к рибосомам передается посредством информационной РНК, синтезируемой в ядре на одной из цепей молекулы ДНК, как на матрице. Информация относительно первичной структуры того или иного белка записана на соответствующем участке молекулы ДНК, называемом геном: последовательность трех соседних нуклеотидов (триплет) кодирует одну определенную аминокислоту в полипептидной цепи. Переписав эту информацию в процессе транскрипции, информационная РНК затем выходит из ядра, соединяется с рибосомами и передает эту информацию для синтеза данного белка в процессе трансляции.
Жизнь клетки протекает в постоянном взаимодействии с окружающей средой, изменения в которой не могут не отражаться на функциональном состоянии клетки. В определенном диапазоне действия внешнего фактора уровень клеточных функций меняется градуально. Если же изменения превышают обычную норму, то внешний агент становится раздражителем. Раздражитель - это внешнее воздействие, достигшее пороговой силы. Способность живых структур отвечать на действие раздражителя называется раздражимостью.
В качестве раздражителей может выступать любой вид энергии - механическая, химическая, электрическая, световая, тепловая. Сила ответной реакции, эффект раздражения, определяется количеством раздражения - произведением силы раздражителя на время его действия. Таким образом, слабый агент, если он действует достаточно долго, может оказывать такое же действие, как и сильный. Другим важным свойством раздражимости является суммация раздражения. Отдельные внешние воздействия различной напряженности могут суммироваться, достигая порогового значения. Демонстрирует суммацию раздражения следующее простое явление. Усик вьющегося растения совершает в воздухе колебательные движения. Если подвести к нему палочку, то вначале он, столкнувшись с ней, отталкивается несколько раз. Когда в результате столкновений происходит суммация раздражения и достигается пороговая сила, возникает ответная реакция и усик обвивается вокруг опоры.
Явления суммации раздражения имеет большое приспособительное значение. Если бы каждое слабое воздействие вызывало ответную реакцию, то этих реакций было бы бесчисленное множество и организм тратил бы слишком много энергии непроизводительно. Суммация раздражения позволяет экономно расходовать энергию, затрачивая ее лишь в ответ на раздражитель достаточной силы.
Русский физиолог Н.В. Введенский впервые отметил единство признаков возбуждения и повреждения (1901). В дальнейшем эта мысль была развита учеными Д.Н. Насоновым и В.Я. Александровым, и их исследования приобрели широкую известность. Ими было установлено, что в ответ на раздражители и повреждающие агенты в клетке возникают неспецифические (не зависящие от природы действующего агента) изменения, которые проявляются рядом ответных реакций. Реакции эти следующие.
Уменьшение степени дисперсности цитоплазмы («оструктуривание»). Рассматривая в световой микроскоп растительную клетку при малом и среднем увеличениях, мы не видим цитоплазмы из-за высокой степени дисперсности последней. Стоит, однако, чем-либо подействовать на клетку - уколоть, добавить гипертонический раствор, подействовать электрическим током, как цитоплазма сразу станет заметной, так как размеры составляющих ее частиц увеличатся.
Увеличение общей проницаемости. При повреждающем воздействии из клетки в окружающую среду выходят самые разнообразные вещества, которые в неповрежденной клетке прочно удерживаются: чем сильнее увеличивается проницаемость, тем больше степень повреждения. На этом основаны методы диагностики устойчивости к морозу, засухе и другим неблагоприятным факторам среды. Подвергнутые воздействию повреждающего агента растительные ткани погружают в бидистиллированную воду, после чего анализируют состав образовавшегося раствора.
Повышение у цитоплазмы и ядра сродства к витальным (прижизненным) красителям. На этом показателе основан способ определения жизнеспособности семян.
Неспецифичность ответных реакций на раздражители и повреждающие агенты разного рода связана с общими изменениями в структуре клеточных белков. Любой из внешних факторов, достигших пороговой силы, нарушает слабые связи, поддерживающие специфическую конформацию молекул. Упрощение структуры, «развертывание» глобулы представляет собой денатурацию, которая может быть обратимой или необратимой (коагуляция). Раскручивание белковых глобул приводит к уменьшению дисперсности цитоплазмы, повышению вязкости, сродства к красителям, дестабилизации мембран. Последнее обстоятельство ярко проявляется еще в одной неспецифической реакции клетки: при действии раздражителя и повреждающего фактора МП падает. Как нам уже известно, МП генерируется и поддерживается прижизненными структурными и функциональными свойствами клетки и обеспечивается непрерывной выработкой метаболической энергии. При достижении внешним агентом пороговой силы МП начинает снижаться, иногда происходит перезарядка мембраны - поверхность клетки негативируется. Падение МП - хороший показатель повреждения. Так, при действии ядом цианидом на колеоптили овса МП упал с -119 до -42 мВ; в отсутствие кислорода МП гипокотиля вигны составил лишь -40 мВ, тогда как в контрольных условиях он был равен -111 мВ.
В ответ на сильное раздражение (механическое, химическое, температурное, электрическое, фото- и радиостимулы) может возникнуть другая биоэлектрическая реакция - потенциалы действия (ПД). Они зарегистрированы у растений тыквы, гороха, Фасоли, кукурузы, подсолнечника, свеклы и др. Суть этого явления в следующем. При резком изменении какого-либо фактора увеличивается ионная проводимость мембраны; за счет входящего в клетку кальция происходит деполяризация мембраны, при этом внешняя поверхность может стать отрицательной по отношению к внутренней. Затем за счет выходящего ионного тока калия потенциал возвращается к исходному уровню. Возбужденный участок мембраны сам становится источником возбуждения для соседнего участка, где повторяются уже описанные двухфазные изменения. Потенциалы как бы бегут вдоль мембраны. Так возникает и распространяется ПД, с помощью которого по растению передаются сигналы о происходящих во внешней среде изменениях. После достижения ПД какого-либо органа наступает ответная физиологическая реакция. Особенно хорошо она проявляется у «чувствительных» растений. Например, у мимозы вслед за механическим раздражением листа регистрируется ПД, который, достигая листовой подушечки, вызывает в ней изменения тургора, что, в свою очередь, приводит к опусканию листочков. Но не только у подобных растений ПД вызывает физиологический эффект. В Московской сельскохозяйственной академии им. К. А. Тимирязева профессором П. С. Беликовым (1964) было показано, что раздражение корней растений пшеницы концентрированными солями или высокой температурой генерируют ПД, который, распространяясь, достигает листа. Этот сигнал вызывает изменения фотосинтетической активности.
Не только биопотенциалы, но и другие показатели при действии раздражителей изменяются волнообразно, двухфазно. Так, сразу же после начала теплового воздействия вязкость цитоплазмы сначала уменьшается, а уже затем увеличивается; скорость движения цитоплазмы сначала возрастает, а потом снижается; выход веществ из клетки изменяется волнообразно.
Колебательный характер ответных реакций объясняется тем, что при действии на клетку раздражителя в ней одновременно наблюдается несколько функциональных состояний (альтераций) - повреждение, возбуждение, закалка, репарация. Повреждение выражается в нарушении структуры и функций клетки. Возбуждение приводит к активации клеточной деятельности, в результате чего возникает закалка - действие раздражителя воспринимается в меньшей степени. На фоне закалки происходит восстановление исходных структур и функций - репарация. Клетка адаптируется к данному уровню внешнего фактора. Перечисленные процессы имеют разную направленность и противоречивый характер. В результате их взаимодействия переход клетки из одного состояния в другое не бывает плавным, а представляет собой колебательный процесс.
Характерными особенностями временного хода колебательного процесса являются время наступления ответной реакции, амплитуда и длина волны. Уровень каждого из этих параметров может служить критерием силы повреждения. Эти параметры могут быть использованы для диагностики устойчивости к различным воздействиям. Чем раньше наступает ответная реакция и больше ее амплитуда, тем более уязвим объект. В качестве примера приведем данные профессора И.И. Гунара (1972) - одного из первых исследователей биоэлектрических явлений у растений. Исследовали биоэлектрическую реакцию растений морозоустойчивого сорта озимой пшеницы Ульяновка и слабоустойчивого к морозу сорта Безостая 1. Оказалось, что под воздействием резких колебаний температуры у неустойчивого сорта возникают быстрые и резкие колебания потенциалов; устойчивый сорт реагирует слабее.
Помимо неспецифических реакций растительной клетки, в растительном организме проявляется множество специфических изменений на стрессоры различной природы. Об этих специфических реакциях будет рассказано при рассмотрении вопросов устойчивости растений к неблагоприятным факторам среды.
Итак, все живые системы обладают свойством раздражимости, которое позволяет им воспринимать изменения во внешней среде и реагировать на них структурными и функциональными перестройками. Под действием раздражителей в клетке в первую очередь возникают изменения в нативной структуре белков и состоянии биологических мембран. Уровень ответных реакций и характер их временного хода может использоваться для диагностики функционального состояния растений и их устойчивости к стрессорам.
Живая клетка, как и организм в целом, состоит из тех же химических элементов и подчиняется тем же общим законам, что и неживая природа. Однако живые структуры отличаются от неживых уникальными особенностями своего существования. Одним из важнейших условий, обеспечивающих жизнь, является способность к внутренней регуляции клеточных процессов. Существует несколько систем регулирования. Их совместная деятельность приводит к быстрым, направленным и экономичным перестройкам, обеспечивающим поддержание гомеостаза и оптимальный уровень функций в условиях непостоянной внешней среды при выполнении наследственной программы. Системы эти следующие.
Генетическая. Обеспечивает включение и выключение отдельных генов, ответственных за синтез специфических белков, и осуществляется за счет уникальной структуры ДНК и саморегуляции ее деятельности.
Трофическая. Реализуется с помощью химических веществ, продуктов метаболизма. Они могут использоваться как источники для синтетического и энергетического обмена, а также выполнять в клетке «тонкую настройку», выступая как регуляторы ферментативной активности.
Энергетическая. Выполняется системами, ответственными за новообразование энергоемких молекул, прежде всего АТФ, способных снабжать энергией все виды работ в клетке.
Гормональная регуляция - один из самых тонких механизмов структурных и функциональных изменений. О специфических веществах - гормонах - и принципах гормонального регулирования процессов жизнедеятельности будет рассказано в разделе «Рост и развитие растений».
Все регуляторные системы работают не только в отдельной клетке, но и на уровне многоклеточного организма, обеспечивая динамическое взаимодействие частей, надежность и целостность сложной живой системы.
 2014-02-10
2014-02-10 3297
3297