.
Здесь 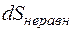 - элементарное приращение энтропии, произведённое в произвольном неравновесном процессе.
- элементарное приращение энтропии, произведённое в произвольном неравновесном процессе.
В адиабатически замкнутой системе любой неравновесный процесс идет в сторону возрастания энтропии. Равновесие в замкнутой системе возникает тогда, когда её энтропия достигает максимума.
#5. Характеристические функции.
В случае равновесных процессов два начала ТД могут быть сформулированы в виде двух дифференциальных равенств:
· I-е: 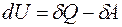
· II-е: dQ=T×dS,
Их можно объединить в одно:
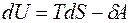 .
.
Это уравнение называется основным уравнением термодинамики равновесных процессов.
Как говорилось в I-й лекции по ТД, элементарная работа
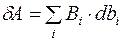 ,
,
что для системы «газ» превращается в выражение
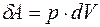 .
.
Дальнейшее изложение будем проводить именно для газа, но возможно обобщение на произвольную равновесную ТД систему. Итак, основное уравнение ТД для равновесных процессов газа в отсутствие внешних полей:
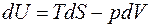 .
.
Т.е. мы получили дифференциальное уравнение, куда входят либо функции, либо параметры ТД-состояния Оно даёт возможность выразить все величины, определяемые равновесным ТД состоянием через частные производные одной единственной характеристики состояния, выраженной через две другие характеристики как через независимые переменные. Такая функция называется характеристической функцией ТД-системы.
|
|
|
К примеру, из основного уравнения:
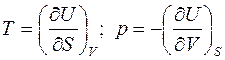 ,
,
т.е. при задании ТД-состояния с помощью S и V в качестве характеристической функции выступает внутренняя энергия U (S, V).
Мы не будем приводить все возможные характеристические функции, которые ещё носят название ТД-потенциалов, а приведем, кроме внутренней энергии, еще одну. Добавим и вычтем в правой части основного уравнения член S×dT:
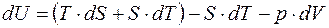 ;
;
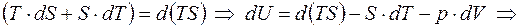
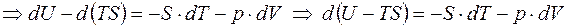
Определение: свободной энергией равновесного состояния называется его функция
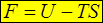
Из предыдущего уравнения следует:
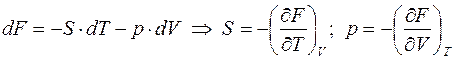 .
.
Т.е. если ТД состояние задаётся объёмом и температурой (система находится в термостате), то её характеристической функцией является свободная энергия F (V, T). В этом случае
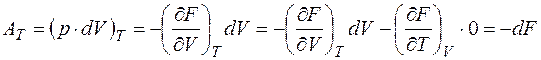 .
.
Подобно энтропии понятие свободной энергии можно обобщить на неравновесные состояния. В этом случае в её выражении будет стоять не температура системы, а температура окружения, в котором находится система. Тогда, используя
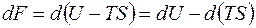 ,
,
в произвольном (и неравновесном, и равновесном) случае имеем
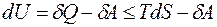 ,
,
поскольку 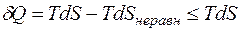 . Значит,
. Значит,
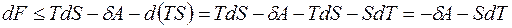 .
.
Если d А= 0 и dT= 0, то 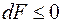 . Т.е. в любых процессах системы, находящейся в термостате, в которых не совершается работа, свободная энергия не возрастает. Равновесие в этом случае возникает, когда свободная энергия минимальна. Это утверждение является формулировкой II-го начала для систем в термостате. В термостатированной системе в отсутствие работы процессы, идущие с уменьшением свободной энергии, являются необратимыми.
. Т.е. в любых процессах системы, находящейся в термостате, в которых не совершается работа, свободная энергия не возрастает. Равновесие в этом случае возникает, когда свободная энергия минимальна. Это утверждение является формулировкой II-го начала для систем в термостате. В термостатированной системе в отсутствие работы процессы, идущие с уменьшением свободной энергии, являются необратимыми.
|
|
|
 2014-02-12
2014-02-12 349
349







