P-элементы, типические, неметаллы (астат полуметалл), галогены.
СТРОЕНИЕ ЭЛЕМЕНТОВ ПОДГРУППЫ VIIA
1. Строение атомов элементов подгруппы VIIА:
В состав подгруппы входят атомы галогенов, общая электронная формула внешнего валентного уровня, у которых ns2np5. У фтора отсутствует внешний nd0 подуровень, который есть у остальных галогенов. Результат этого низкая валентность фтора (только 1) и способность проявлять более высокие валентные возможности у атомов других галогенов (3, 5, 7). У брома, йода, астата добавляется (n 1)d10 подуровень, у астата (n 2)f14 подуровень. Так как у брома заполненный 3d10 подуровень проявился впервые, он очень сильно экранирует внешнюю 4s2 электронную пару, что приводит к её повышенной устойчивости, трудности окисления брома до брома (VII). Аналогичная картина наблюдается для астата из-за экранировки 6s2 пары 4f14 электронами. Атомы галогенов могут проявлять и нетипичные валентности и степени окисления в молекулярных радикалах и промежуточных частицах.
|
|
|
Электронная диаграмма нейтрального атома элемента Hal (Hal ≠ F):
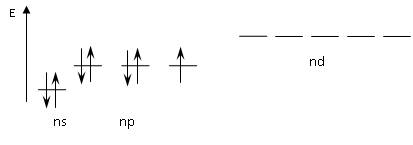
Рис.1. Электронная диаграмма нейтрального атома элемента Hal
У F нет nd подуровня.
Отсюда следует, что фтор только окислитель, а восстановителем быть не может. Поэтому для фтора неизвестны соединения с положительной степенью окисления.
Прочность молекулы фтора, несмотря на наименьшее межъядерное расстояние, относительно других галогенов, намного меньше по сравнению с молекулами хлора и брома. По величинам энтальпии и рК молекула фтора сравнима с молекулой иода. Химическая связь в молекуле фтора менее прочна, но более жестка. Сравнительно невысокая прочность молекулы фтора, которая является одним из факторов его высокой химической активности, обусловлена отсутствием у фтора d-орбиталей. В молекулах остальных галогенов имеет место дополнительное -связывание за счет р-электронов и d-орбиталей.
Сродство к электрону у атома фтора также меньше, чем у хлора. Фтор является менее электрофильным элементом по сравнению с хлором. Это объясняется кайносимметричностью 2р-электронов атома фтора и связанным с ней эффектом обратного экранирования. Дело в том, что 2р-орбитали в атоме фтора сильнее притянуты к ядру и лежат глубже полностью заполненной электронами некайносимметричной 2s-орбитали. Последняя, будучи полностью заселенной, отталкивает присоединяемый атомом фтора электрон, уменьшая электронное сродство и увеличивая энергии ионизации 49 с.457-458.
В ряду F Cl Br I разница энергии 2s- и 2p-орбиталей увеличивается. Эффект экранирования приводит к увеличению энергии 3s- и 3p-, 4s- и 4p-орбиталей и т.д., а главное, к уменьшению их разности по сравнению с 2s- и 2p-орбиталями: если для фтора разница в энергии орбиталей составляет 27,7 эВ, то для хлора – 11,6 эВ 16.
|
|
|
2. Для элементов подгруппы VIIA характерны следующие валентности:
Таблица 2. Валентность элементов подгруппы VIIА
Элемент Валентности
F 1
Cl 1; 3; 5; 7
Br 1; 3; 5; 7
I 1; 3; 5; 7
At 1; 3; 5
3. Для элементов подгруппы VIIA характерны следующие степени окисления:
Таблица 3. Степени окисления элементов подгруппы VIIА
Атом Устойчивые степени окисления
9F -1; 0
17Cl -1; 0; +1; +3; (+4); +5; (+6); +7
35Br -1; 0; +1; (+3); (+4); +5; +7
53I -1; 0; +1; (+3); +5; +7
85At 1, 0, + 1, +3, +5
4. Координационные числа:
Координационные числа атомов галогенов зависят как от природы галогена, так и от типа связи и природы ближайшего окружения.
В молекулярных соединениях атомы галогенов проявляют низкие координационные числа (1-2). Например, один в HCl, два за счёт водородной связи в ассоциатах фтороводорода и образованных им ионах (HF…HF, K[F….HF]) и за счёт мостиковых связей в димерах хлорида алюминия (Al2Cl6). Координационное число центрального иода в иодате K2(I2) также равно двум. В ионных соединениях координационные числа выше. Атомы хлора в LiCl проявляют невысокое координационное число 4 (Li4Cl4), в хлориде натрия координационное число уже шесть (Na6Cl6).
Галогеноводоро́ды — общее название соединений, образованных из водорода и галогенов:
Плавиковая кислота — водный раствор фтороводорода
Соляная кислота — водный раствор хлороводорода
Бромоводородная кислота — водный раствор бромоводорода
Иодоводородная кислота — водный раствор иодоводорода
Астатоводородная кислота — водный раствор астатоводорода
Физические свойства галогеноводородов.
По мере увеличения размера атомов галогенов межатомное расстояние Н-Х увеличивается, энергия связи Н- Х уменьшается. Уменьшение энергии связи Н-Х приводит к повышению значений энтальпий образования в ряду HF-HI, например, HI в стандартных условиях образуется из простых веществ уже с поглощением тепла.
В стандартных условиях галогеноводороды - газы. С ростом массы и размеров молекул усиливается межмолекулярное взаимодействие и, как следствие, повышаются температуры плавления (Тпл) и кипения (Ткип). Однако для HF величины Тпл и Ткип, полученные экстраполяцией в ряду однотипных соединений HF-HCl-HBr-HI, оказываются существенно ниже, чем экспериментальные (табл.4). Аномально высокие температуры плавления и кипения объясняются усилением межмолекулярного взаимодействия за счет образования водородных связей между молекулами HF:
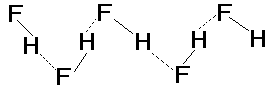
Твердый HF состоит из зигзагообразных полимерных цепей. В жидком и газообразном HF вплоть до 60оС присутствуют полимеры от (HF)2 до (HF)6. Для HCl, HBr, HI образование водородных связей не характерно из-за меньшей электроотрицательности атома галогена.
Все галогеноводороды — бесцветные газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов.
Химические свойства. Галогеноводороды хлора, брома, йода при обычных условиях — газы. Хорошо растворимы в воде, при растворении протекают следующие процессы:
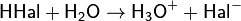
Процесс растворения сильно экзотермичен. С водой HCl, HBr и HI образуют азеотропные смеси, которые содержат соответственно 20,24; 48; 57 % НГ.
Галогены в галогеноводородах имеют степень окисления −1. Могут выступать в качестве восстановителей, причём восстановительная способность в ряду HCl — HBr — HI увеличивается:
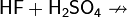
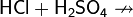
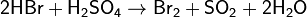
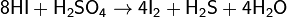
Иодоводород является сильным восстановителем и используется как восстановитель во многих органических синтезах. При стоянии раствор HI вследствие постепенного окисления HI кислородом воздуха и выделения иода постепенно принимает бурую окраску:
|
|
|
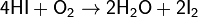
Аналогичный процесс протекает и в водном растворе HBr, но намного медленнее.
Растворы галогенов — сильные кислоты, в которых ион H+ выступает в качестве окислителя. Галогеноводородные кислоты реагируют с металлами, потенциал которых < 0, но так как ионы I− (в меньшей степени Br−) хорошие комплексообразователи, HI может реагировать даже с серебром (E0 = +0,8 В).
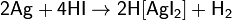
 2015-01-30
2015-01-30 1790
1790








