Раствор представляет собой гомогенную смесь веществ переменного состава, состоящую из растворителя и растворённых веществ. В зависимости от агрегатного состояния растворителя раствор может быть жидким или твёрдым. Жидкими являются растворы газов, жидкостей или твёрдых веществ в жидких растворителях. В зависимости от природы растворителя различают водные и неводные растворы. Наиболее распространёнными и имеющими наибольшую важность являются водные растворы, которые и рассматриваются в контрольной работе.
Важнейшей характеристикой любого раствора является его концентрация. Концентрация представляет собой отношение количества растворённого вещества к общему количеству раствора или растворителя.
Молярная концентрация (молярность) СМ равна отношению числа молей растворённого вещества nв к объёму раствора V: СМ = 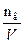 =
= 
где mв – масса растворённого вещества в граммах, М – его молярная масса.
Поскольку на практике объём жидкостей чаще всего выражают в литрах, молярная концентрация выражается в моль/л. Для обозначения молярности растворов часто используется иная символика. Так записи 1М и 0,1М означают, соответственно, одно- и децимолярный растворы.
|
|
|
Нормальная концентрация (нормальность) Сн равна отношению числа молей эквивалентов растворённого вещества nэ к объёму раствора V:
Сн =  =
= 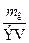 , где mв – масса растворённого вещества в граммах, Э – его эквивалентная масса – масса 1 моля эквивалентов в граммах. Размерность нормальности – моль-экв/л. Например, Сн=2моль-экв/л – двунормальный раствор; Сн=0,01моль-экв/л – сантинормальный раствор. Как и в случае молярности, для обозначения нормальности можно пользоваться краткими записями: 2н – двунормальный раствор; 0,01н – сантинормальный раствор.
, где mв – масса растворённого вещества в граммах, Э – его эквивалентная масса – масса 1 моля эквивалентов в граммах. Размерность нормальности – моль-экв/л. Например, Сн=2моль-экв/л – двунормальный раствор; Сн=0,01моль-экв/л – сантинормальный раствор. Как и в случае молярности, для обозначения нормальности можно пользоваться краткими записями: 2н – двунормальный раствор; 0,01н – сантинормальный раствор.
Титр показывает число граммов растворенного вещества в 1 мл раствора:
Т = 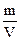 , где m – масса растворенного вещества, г; V – объем раствора, мл.
, где m – масса растворенного вещества, г; V – объем раствора, мл.
Процентной концентрацией раствора называется массовая доля растворённого вещества, выраженная в процентах. Массовая доля растворённого вещества w равна отношению его массы mв к общей массе раствора: w = 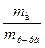 ? 100%,выражается в % или в долях единицы.
? 100%,выражается в % или в долях единицы.
Моляльная концентрация (моляльность) показывает число моль растворенного вещества в 1000 г растворителя:
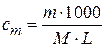 , где cm – моляльная концентрация, m и М – соответственно масса и мольная масса растворенного вещества, г; L – масса растворителя, г.
, где cm – моляльная концентрация, m и М – соответственно масса и мольная масса растворенного вещества, г; L – масса растворителя, г.
Переход от одного способа выражения концентрации к другому производят по формулам:
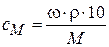 ;
; 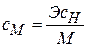 ;
; 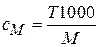 ;
;  ;
; 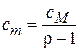 ;
;
 ;
;  ;
; 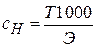 ;
; 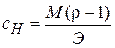 ;
; 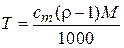 ;
;
 ;
; 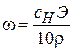 ;
; 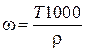 ;
; 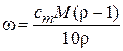 ;
; 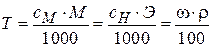 .
.
Задача 1. В объеме воды V(H2O) растворили массу вещества m. Плотность полученного раствора ρ.
а) найдите массовую долю вещества в растворе, молярную и нормальную концентрации, титр полученного раствора;
|
|
|
б) Какие объемы полученного раствора и воды нужно взять, чтобы приготовить объем V1 (в мл) раствора данного вещества с концентрацией См1?
в) Какой объем раствора вещества Х с концентрацией Сн необходим для нейтрализации раствора полученного в пункте б?
а) V(H2O) = 500 мл, вещество – H2SO4, m(H2SO4) = 68,5 г, ρ = 1,08 г/мл;
б) V1 = 200 мл, См1 = 0,8М
в) вещество Х – NH3, Сн(NH3) = 0,6н.
а) Найдите массовую долю вещества в растворе, молярную и нормальную концентрации, титр полученного раствора.
Находим массу раствора: m(р-ра) = m(растворенного вещества) + m(воды)
m(воды) = V(воды)?ρ(воды) = 500 мл? 1 г/мл = 500 г.
m(р-ра) = m(H2SO4) + m (H2O) = 68,5 г + 500 г = 568,5 г.
ω = 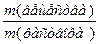 ?100% =
?100% = 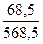 ? 100% = 12,06 %.
? 100% = 12,06 %.
Для расчета молярной концентрации (СМ) данного раствора требуется значение молярной массы растворенного вещества, находим его по сумме атомных масс элементов, входящих в состав вещества:
M(H2SO4) = 2?Ar(H) + Ar(S) + 4?Ar(O) = 2?1 + 32 + 4?16 = 98 г/моль.
Далее рассчитываем СМ, используя имеющиеся данные:
СМ =  =
=  = 1,32 моль/л
= 1,32 моль/л
Для расчета молярной концентрации эквивалента (Сн) данного раствора требуется значение молярной массы эквивалента растворенного вещества; эквивалент кислоты определяется как отношение его молярной массы к количеству катионов водорода H+ в кислоте:
Э(кислоты) =  =
=  = 49 г-экв/моль.
= 49 г-экв/моль.
Далее рассчитываем Сн, используя имеющиеся данные:
Сн = 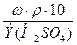 =
=  = 2,64 моль-экв/л
= 2,64 моль-экв/л
Для расчета титра (Т) раствора необходимо рассчитать объем (V) данного раствора: V(раствора) = 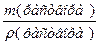 =
= 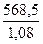 = 526,4 мл.
= 526,4 мл.
Рассчитываем Т, используя имеющиеся данные:
Т =  =
= 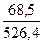 = 0,13 г/мл
= 0,13 г/мл
б) Какие объемы полученного раствора и воды нужно взять, чтобы приготовить объем V1 (в мл) раствора данного вещества с концентрацией См1?
Для выполнения задания удобно использовать диагональную схему, в которой в центре записывается значение заданной (т.е. той концентрации вещества, которая должна быть в приготовленном растворе), в верхнем левом углу указывается концентрация исходного (т.е. того раствора, который взят для приготовления заданного раствора), в левом нижнем углу – концентрация раствора для смешивания с исходным раствором (в данной задаче по условию взята чистая вода, без содержания в ней каких-либо веществ, таким образом в левом нижнем углу будет указана концентрация – 0).
 |
Затем производят вычитание (из большего меньшее) по каждой диагонали
 |
(1,32 – 0,8= 0,52 и 0,8 – 0 = 0,8) и ответы записывают по концам диагонали справа:
Полученные цифры показывают, сколько частей по объему следует взять при смешивании исходных растворов 0,8 частей 1,32М исходного раствора серной кислоты и 0,52 частей воды для приготовления 0,8М раствора.
Далее рассчитываем необходимые объемы компонентов (исходного раствора и воды) для приготовления заданного раствора (с концентрацией СМ = 0,8М и объемом V = 200 мл):
V(H2SO4) =  ?V(заданный) =
?V(заданный) = 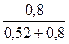 ?200мл = 78,8 мл
?200мл = 78,8 мл
V(H2O) = 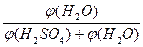 ?V(заданный) =
?V(заданный) = 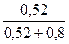 ?200мл = 121,2 мл
?200мл = 121,2 мл
в) Какой объем раствора вещества Х с концентрацией Сн необходим для нейтрализации раствора полученного в пункте б?
2NH3 + H2SO4 →(NH4)2SO4
Для расчета необходимо воспользоваться законом эквивалентов для растворов с нормальной концентрацией: Сн1V1 = Сн2V2
В пункте б данной задачи был получен раствор с концентрацией 0,8М, т.е. с молярной концентрацией, поэтому нужно перейти от молярной концентрации к молярной концентрации эквивалента (нормальной концентрации):
Сн(H2SO4) =  =
= 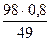 = 1,6 моль-экв/л
= 1,6 моль-экв/л
Сн(NH3) = 0,6 моль-экв/л – по условию задачи. Рассчитываем объем NH3, необходимый для нейтрализации 200 мл 1,6н раствора H2SO4:
Сн (NH3)?V(NH3)= Сн(H2SO4)?V(H2SO4), отсюда
V(NH3) = 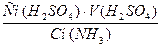 =
= 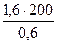 = 533 мл.
= 533 мл.
 2015-01-30
2015-01-30 15331
15331
