Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат: Существуют некоторые стационарные состояния, находясь в которых электрон не излучает и не поглощает энергию. Второй постулат: При переходе атома из одного стационарного состояния в другое испускается или поглощается квант энергии.
hνk n = Ek - En;
отсюда
ν k n = 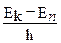 ; (213)
; (213)
где h –постоянная Планка. При Еk > En происходит излучение фотона, при Еk < En происходит поглощение фотона.
Различные возможные стационарные состояния атома, образованного из атомного ядра и электрона, определяются по Бору соотношением:
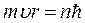 (214)
(214)
где m –масса электрона, υ –его скорость, r – радиус круговой орбиты, n – целое число; 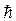 –приведенное значение постоянной Планка.
–приведенное значение постоянной Планка.
|
|
|
Бесконечно долго атом может находиться лишь в стационарном состоянии с минимальным запасом энергии. Это состояние атома называется основным. Все остальные стационарные состояния атома называются возбужденными.
Атом, поглощая свет, переходит из стационарного состояния с меньшим запасом энергии в стационарное состояние с большим запасом энергии. При этом он поглощает излучение той же частоты, которое излучает переходя из высших энергетических уровней на низшие. Из любого возбужденного состояния атом самопроизвольно может переходить в основное состояние. Этот переход сопровождается излучением фотонов. Время жизни атома в возбужденном состоянии обычно не превышает 10-8 –10-7 с.
На основании постулатов Бора можно рассчитать радиусы стационарных орбит в атоме водорода: Центростремительная сила при движении электрона по орбите является кулоновской силой
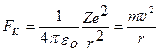 (215)
(215)
Из выражения (214) 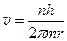 или
или 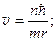 подставляя в (215), получим:
подставляя в (215), получим:
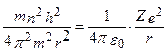
Отсюда,
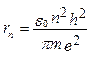 или
или 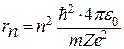
Двигаясь по круговой орбите электрон обладает определенным запасом кинетической энергии, а также потенциальной энергии в поле атомного ядра.
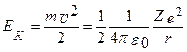 (216)
(216)
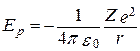 (217)
(217)
Обозначим полную энергию электрона на стационарной орбите с номером n через En:
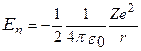 ; (218)
; (218)
Т.к. 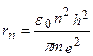 , то подставляя в формулу (218), получим:
, то подставляя в формулу (218), получим:
Еполн = - 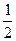 .
. 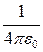
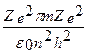 = -
= - 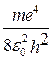 .
. 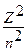 (219)
(219)
Знак минус означает, что электрон находится в связанном состоянии. Целое число n, определяющее энергетические уровни атома, называется главным квантовым числом.
При переходе из состояния n в состояние m испускается квант энергии
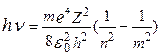 ;
;
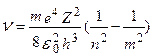
.

При Z = 1 ν = - 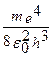 (
(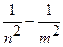 ) = R (
) = R (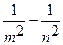 );
);
|
|
|
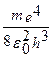 = R = 3,29.1015 c1 – постоянная Ридберга.
= R = 3,29.1015 c1 – постоянная Ридберга.
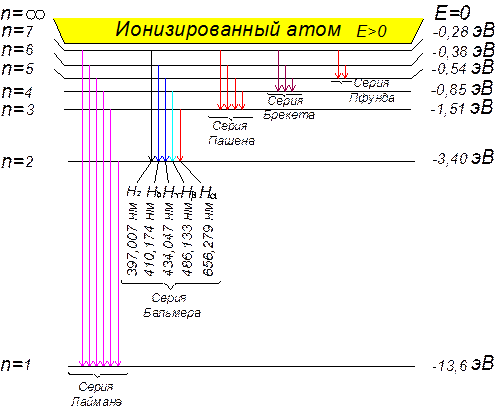
Для наглядного представления возможных энергетических состояний атомов используются энергетические диаграммы (рисунок 74). На них каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем. Самый низкий уровень на диаграмме с n =1 соответствует основному состоянию. Уровни с n > 1 располагаются выше и называются возбужденными. Атом водорода обладает минимальной энергией
(Е1 = -13,5 эВ) при n = 1 и максимальной энергией (Е¥ = 0) при n =¥. Значение Е¥ = 0 соответствует энергии ионизации атома (отрыву от него электрона). Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на энергетической диаграмме, направление перехода указывается стрелкой.
С помощью этих диаграмм легко объяснить происхождение линейчатых спектров.
ЛЕКЦИЯ 12
 2015-01-30
2015-01-30 3930
3930
