При компьютерном моделировании в химии и химической технологии начальным этапом является определение типа химического процесса, определение его стадийности, написание химических и электрохимических реакций, протекающих в системе.
Соотношение компонентов, участвующих в химической реакции, показывает стехиометрическое уравнение. Так как уравнение химической реакции связывает исходные реагенты и продукты реакции, то оно представляет собой материальный баланс реакции в целом или ее отдельных элементарных стадий. В общем случае (и чаще всего), химический процесс протекает стадийно, т.е. через ряд промежуточных соединений или сопутствующих реакций. Механизм химической реакции раскрывает элементарные стадии превращения исходных компонентов в конечные продукты.
аА + вВ ⇄ сС (1)
где а – количество молей вещества А, в – количество молей вещества В, с – количество молей вещества С. Коэффициенты а, в, с называются стехиометрическими коэффициентами реакции.
Скоростью химической реакции υ называется изменение количества молей компонента (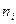 ), происходящее в единицу времени (
), происходящее в единицу времени (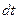 )в единице объема (
)в единице объема (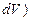 :
:
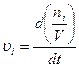 (2)
(2)
Выражение (2) называется кинетическим уравнением реакции.
Отношение числа молей компонента 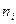 к объему реакционной массы представляет собой концентрацию i-го компонента:
к объему реакционной массы представляет собой концентрацию i-го компонента:
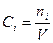 (3)
(3)
Поэтому при постоянном объеме реагентов скорость реакции можно представить как изменение концентрации компонента в единицу времени:
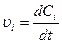 (4)
(4)
Для реакции типа (1) скорость при постоянной температуре выражается уравнением:
uA 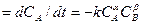 (5)
(5)
Это выражение получают на основании закона действия масс. Здесь a и b определяют порядок реакции. Если стехиометрическое уравнение соответствует механизму реакции (или одной из ее стадий), то ее порядок равен числу молекул, вступивших в реакцию (молекулярность реакции), т.е. a=a, b=b.
Механизм реакции называют истинным, если каждая стадия описывается кинетическим уравнением, составленным в соответствии со стехиометрическим уравнением этой стадии. При этом сумма стехиометрических коэффициентов исходных компонентов равна общему порядку реакции, а порядок реакции по отдельному компоненту равен стехиометрическому коэффициенту этого компонента. В уравнении закона действия масс коэффициент k есть константа скорости химической реакции, величина которой зависит от природы реагирующих веществ, температуры, присутствия катализаторов, но не зависит от концентраций веществ. Зависимость константы от температуры Т носит нелинейный характер и обычно описывается уравнением Аррениуса:
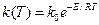 (6)
(6)
где k0 – предэкспоненциальный множитель, T – температура, E - энергия активации – избыточная энергия, которой должны обладать молекулы или атомы для того, чтобы их столкновение могло привести к образованию нового вещества, R – универсальная газовая постоянная, равная 8.314 Дж/моль·К.
Чтобы упростить запись кинетических уравнений, константу скорости реакции рекомендуется относить к одному молю реагента, а в соответствующем выражении скорости реакции (или стадии) умножать ее на стехиометрический коэффициент. Таким образом, при выводе уравнения скорости стехиометрию химической реакции следует учитывать не только в величинах порядков, но и в коэффициентах дифференциального уравнения скорости. Например, в реакции О2 + 2NO ® 2NO2 скорость поглощения NO в два раза выше, чем О2, поэтому система дифференциальных уравнений кинетики имеет вид:
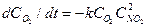
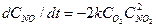 (7)
(7)
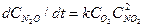
Как видно из системы уравнений (7), приведенный выше процесс описывается нелинейными дифференциальными уравнениями. Таким образом, либо не равенство стехиометрических коэффициентов единице, либо наличие нескольких реагирующих веществ приводит к нелинейности изучаемого процесса.
Следует подчеркнуть, что для решения системы дифференциальных уравнений с целью получения кинетических кривых для каждого из них необходимо задать начальные условия, т.е. оговорить исходные концентрации соответствующих реагентов. Иногда для формального описания кинетики используют дифференциальные уравнения, подобные приведенным выше, но при этом степени a и b выступают в роли некоторых эмпирических констант и часто принимают дробные значения.
При изучении химических реакций в реальных условиях возникает проблема составления адекватного математического описания. Обычно обсуждается несколько предполагаемых вариантов механизма реакции. Математические описания могут отличаться по числу элементарных стадий. Чаще всего в качестве неизвестных кинетических параметров выступают константы скорости и порядок отдельных стадий реакции. Параметры модели подбирают, добиваясь максимального соответствия результатов моделирования экспериментальным данным. Чтобы установить адекватность математической модели реакции реальному химическому процессу, нужно решить систему уравнений выбранной модели, и сравнить полученные результаты с экспериментальными данными.
Для определения кинетических параметров химической реакции нужен некий критерий адекватности математической модели. Независимо от метода поиска неизвестных параметров в качестве такого критерия чаще всего используют интегральную функцию ошибок Δ в виде:
- интегрально-разностного критерия
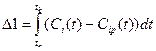 (8)
(8)
- интегрально-квадратичного критерия
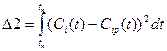 (9)
(9)
где Сi – экспериментальная зависимость концентрации i-го компонента от времени, Сip- расчетная зависимость концентрации i-го компонента от времени, tn и tk – начальный и конечный моменты времени.
Критерий Δ1 равномерно учитывает любые отклонения, а Δ2 характеризуется пониженной чувствительностью к малым отклонениям. Очевидно, что чем меньше критерий, тем ближе расчетная зависимость к экспериментальной. Поэтому определение неизвестных параметров сводится к достижению минимума критерия Δ. Независимо от вида критерия, необходимо вычислять текущую разность экспериментальных и рассчитанных в результате моделирования концентраций.
Математические модели широко используются для изучения и анализа работы аппаратов основных процессов химических технологий – как действующих, так и проектируемых. Например, процессы теплообмена, теплообменники, реакторы, автоклавы и т.п.
В зависимости от поставленной задачи для одного и того же объекта моделирования могут быть получены различные математические модели, используемые для изучения статических и динамических свойств аппарата любого масштаба в стационарных или нестационарных режимах работы, для определения технологических характеристик и параметров.
При моделировании сложного технологического процесса необходимо учитывать влияние большого числа параметров, поэтому удобнее рассматривать совокупность более простых составляющих изучаемого процесса.
Гомогенной реакция называется в том случае, если исходные реагенты и продукты реакции находятся в одной и той же фазе, в одном и том же агрегатном состоянии.
Реакции, протекающие при условии постоянства температуры, являются изотермическими. Здесь имеется в виду не температура окружающей среды, а температура реакционной смеси.
Химическим равновесием называется равенство скоростей прямой и обратной химических реакций.
Если равновесие химической реакции полностью сдвинуто в сторону образования продуктов реакции, то такая реакция называется необратимой. Иными словами, реакция протекает до полного расходования одного из компонентов, и в ходе реакции не наблюдается обратного образования исходных веществ из продуктов реакции.
Обратимой реакцией называется процесс с установившимся динамическим равновесием. Наряду с прямой реакцией образования продуктов, протекает и обратная реакция распада полученных веществ до исходных компонентов со своей скоростью взаимодействия. По мере расходования исходных веществ, т.е. с уменьшением их концентрации, скорость прямой реакции падает, и начинает протекать обратная реакция с нарастающей скоростью.
Последовательно-параллельная реакция включает несколько стадий, на одной из которых протекает реакция взаимодействия одного из продуктов реакции с исходным веществом с образованием нового вещества.
Каталитическая реакция протекает при участии катализатора. Катализатор – компонент, принимающий участие в реакции опосредованно. Катализатор стимулирует протекание реакции, либо ускоряет ее, но сам при этом не взаимодействует ни с одним из компонентов реакции. В присутствии катализатора химическая реакция идет через другие активированные комплексы с меньшей энергией активации, нежели без него.
Неизотермическими реакциями называются реакции, протекающие с неким тепловым эффектом. Они могут быть эндотермические и экзотермические. Эндотермические реакции – реакции, протекание которых сопровождается поглощением энергии, соответственно, экзотермические реакции сопровождаются выделением энергии.
Если при образовании какого-либо соединения выделяется (или поглощается) некоторое количество теплоты, то при разложении этого соединения в тех же условиях такое же количество тепла поглощается (либо выделяется). Надо заметить, что при описании любого процесса постоянно подчеркивается «при равных условиях», потому как бессмысленно сравнивать процессы, происходящие в различных условиях.
Термодинамика
Химическая система – это совокупность объектов, изолированных от окружающей среды. Стандартным состоянием для твердых и жидких веществ является состояние при следующих внешних условиях: температура - 298 К, давление – 1.013·105 Па; а для газов: парциальное давление – давление каждого компонента смеси в отдельности – 1.013 ·105 Па при той же температуре. Любое отклонение от стандартного состояния ведет к изменению в системе, изменению ее свойств, параметров и требует добавлений в химические и термодинамические расчеты, соответствующих реактивным условиям процесса. Любая физическая величина, значение которой в данный момент времени определяется термодинамическими свойствами системы, называется функцией состояния. Важнейшими функциями состояния являются энтальпия (Н), энтропия (S), и энергия Гиббса (G).
Энтальпия или теплосодержание – это функция, равная сумме внутренней энергии (U) системы и работы против внешнего давления (pV):
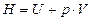 (10)
(10)
Внутренняя энергия системы складывается из энергий вращательного, колебательного и поступательного движения молекул, колебательного движения атомов в молекуле, энергии движения электронов и внутриядерной энергии. Энтальпия образования (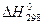 ) – это тепловой эффект реакции образования одного моля соединения из простых веществ в стандартном состоянии системы. Она характеризует стремление системы к упорядочиванию, к повышению устойчивости.
) – это тепловой эффект реакции образования одного моля соединения из простых веществ в стандартном состоянии системы. Она характеризует стремление системы к упорядочиванию, к повышению устойчивости.
Энтропией называется функция состояния, изменение которой при переходе системы из одного состояния в другое равно приведенной теплоте – отношению количества теплоты, полученной системой в изотермическом процессе, к температуре этого процесса.
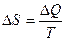 (11)
(11)
Энтропия характеризует стремление системы к разупорядочиванию, к снижению устойчивости. Процессы нагревания, испарения, плавления ведут к увеличению беспорядочного движения атомов и молекул и следовательно к увеличению энтропии. Процессы, связанные с уменьшением беспорядочного движения атомов и молекул, как конденсация, замерзание, кристаллизация снижают энтропию системы.
Свободная энергия Гиббса или изобарно-изотермический потенциал – это функция состояния, равная разности энтальпии системы и произведения абсолютной температуры на энтропию:
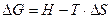 (12)
(12)
Энергия Гиббса используется при изучении химических реакций, протекающих при постоянных температуре и давлении.
Единицы измерения термодинамических величин:
энтальпия [H] = Дж/моль; энтропия [ΔS] = Дж/(К·моль);
свободная энергия Гиббса [ΔG] = Дж/моль.
Закон Гесса: тепловой эффект химической реакции, протекающей при постоянном давлении (изобарный процесс) или при постоянном объеме (изохорный процесс) не зависит от числа промежуточных стадий, а зависит только от начального и конечного состояния системы (веществ).
Следствия из закона Гесса:
- тепловой эффект реакции образования одного моля соединения из простых веществ в стандартном состоянии не зависит от способа его получения;
- стандартный тепловой эффект реакции 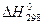 равен сумме стандартных теплот образования продуктов реакции за вычетом стандартных теплот образования исходных веществ:
равен сумме стандартных теплот образования продуктов реакции за вычетом стандартных теплот образования исходных веществ:
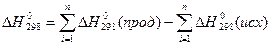 (13)
(13)
Устойчивость химической системы определяется энергией Гиббса. Самопроизвольно протекающие процессы направлены в сторону уменьшения энергии Гиббса. Самопроизвольное протекание реакции возможно при отрицательном изобарно-изотермическом потенциале, чем меньше его величина, тем энергичней протекает данная реакция. Динамическое равновесие системы определяется равенством энергии Гиббса нулю.
Теория электролитической диссоциации изучает теорию распада в воде электролитов на катионы и анионы и определяет кислоты как электролиты, диссоциирующие в водных растворах с образованием ионов водорода (Н+). У сильных кислот, диссоциирующих нацело, кислотные свойства, к которым относятся, в частности, способность взаимодействовать с основаниями с образованием солей и способность взаимодействовать с некоторыми металлами с выделением водорода проявляются в большей степени, у слабых – в меньшей степени. Следовательно, чем лучше кислота диссоциирует, тем больше степень диссоциации и константа диссоциации, и тем кислота сильнее. Гидроксидами или основаниями называются электролиты, диссоциирующие в водных растворах с отщеплением ионов гидроксида ОН-. Чем больше константа диссоциации основания, тем оно сильнее.
Электролитами называют растворы веществ или твердые вещества, способные проводить электрический ток.
Степенью диссоциации электролита (α) называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
Константой диссоциации (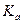 ) называется константа равновесия реакции, отвечающая диссоциации слабого электролита.
) называется константа равновесия реакции, отвечающая диссоциации слабого электролита.
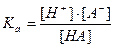 (14)
(14)
Величина 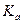 зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы.
зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы.
При ступенчатой диссоциации электролита распад на ионы по последующей ступени всегда происходит в меньшей степени, чем по предыдущей ступени.
Закон разбавления Оствальда позволяет вычислить степень диссоциации (α) при различных концентрациях раствора, если известна его константа диссоциации и, соответственно, вычислить константу диссоциации по известной степени диссоциации при заданных концентрациях.
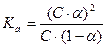 или
или 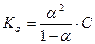 (15)
(15)
В случае слабого электролита α<< 1 и (1- α) → 1, тогда имеем:
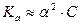 или
или 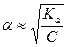 (16)
(16)
Из выражения (15) очевидно, что для слабых электролитов с разбавлением раствора, т.е. со снижением концентрации, степень диссоциации увеличивается.
Кислоты с константой диссоциации, находящейся в пределах 10-4 ÷ 10-2 – средние по силе кислоты. Следовательно, если константа диссоциации меньше значения 10-4, то кислота слабая, а при 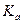 больше величины 10-2 кислота является сильной. К сильным кислотам относятся азотная
больше величины 10-2 кислота является сильной. К сильным кислотам относятся азотная 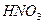 (
(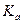 = 43.6 при 25оС), бромводородная
= 43.6 при 25оС), бромводородная 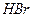 (
(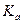 = 109 при 25оС), йодоводородная
= 109 при 25оС), йодоводородная 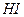 (
(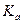 = 1011 при 25оС), марганцевая
= 1011 при 25оС), марганцевая 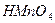 (
(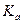 = 200 при 25оС), серная
= 200 при 25оС), серная 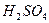 (
(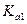 = 1000,
= 1000, 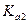 = 10-2 при 25оС), соляная
= 10-2 при 25оС), соляная 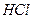 (
(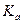 = 107 при 25оС). К слабым кислотам можно отнести угольную
= 107 при 25оС). К слабым кислотам можно отнести угольную 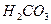 ,
, 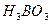 , органические кислоты.
, органические кислоты.
Кислотность раствора характеризуется концентрацией ионов водорода Н+, чем она больше, тем выше кислотность. Концентрацию ионов водорода обычно выражают через водородный показатель и обозначают символом 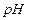 .
. 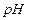 - десятичный логарифм концентрации ионов водорода, взятый с обратным знаком.
- десятичный логарифм концентрации ионов водорода, взятый с обратным знаком.
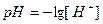 (17)
(17)
Концентрация ионов водорода [H+] выражается в моль/л.
Аналогично гидроксидный показатель 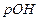 - десятичный логарифм концентрации гидроксидных ионов [OH-] в растворе, взятый с обратным знаком.
- десятичный логарифм концентрации гидроксидных ионов [OH-] в растворе, взятый с обратным знаком.
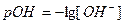 (18)
(18)
Между 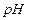 и
и 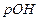 существует определенное соотношение:
существует определенное соотношение:
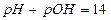 (20)
(20)
Выражение (20) следует из ионного произведения воды:
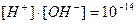 (21)
(21)
Ниже приводятся формулы расчета водородного показателя для некоторых растворов (таб.1).
Таблица 1
Формулы расчета водородного показателя для некоторых растворов
| раствор | Формула | |
| - сильная кислота | 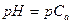
|
| - слабая кислота | 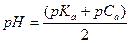
|
| - сильный гидроксид | 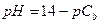
|
| - слабый гидроксид | 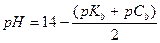
|
| - смесь растворов слабой кислоты и ее соли (кислотный буферный раствор) | 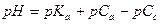
|
| - смесь растворов слабого гидроксида и его соли (щелочной буферный раствор) | 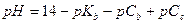
|
| - соль, образованная слабым гидроксидом и сильной кислотой | 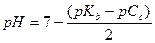
|
| - соль, образованная слабой кислотой и сильным основанием | 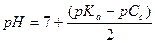
|
| - соль, образованная слабой кислотой и слабым основанием | 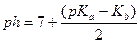
|
Где 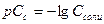
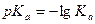
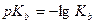
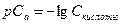
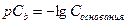
Ка, Кв – константы диссоциации кислоты и гидроксида;
Са, Св, Сс – концентрации кислоты, гидроксида и соли.
В случае сильных электролитов количество ионов в растворе больше, чем в растворах слабых электролитов вследствие их полной диссоциации. Поэтому в несильно разбавленных растворах сильных электролитов движение ионов затруднено в связи со взаимным притяжением ионов. Таким образом, каждый ион окружен шарообразной «ионной оболочкой» противоположно заряженных ионов. С увеличением концентрации раствора увеличивается тормозящее влияние «ионной оболочки» и степень диссоциации падает. В разбавленных растворах сильных электролитов расстояние между ионами увеличивается, и степень диссоциации растет. Для растворов сильных электролитов корректнее пользоваться не концентрациями, а активностями (а):
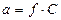 (22)
(22)
где а – активность иона в растворе, С – концентрация,
f – коэффициент активности.
В концентрированных растворах коэффициент активности обычно меньше единицы, а с разбавлением он стремится к единице. Для разбавленных растворов сильных электролитов активность тождественна концентрации. Тогда константа диссоциации примет вид:
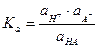 (23)
(23)
 2015-01-21
2015-01-21 1029
1029








