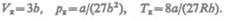 (62.4)
(62.4)
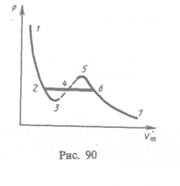
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 91), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму  под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 92), видим, что последняя имеет прямолинейный участок 2 — 6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5— б

|
|
 и 2 — 3. Эти неустойчивые состояния называются метастабильными. Участок 2 — 3 изображает перегретую жидкость, 5 — 6 — пересыщенный пар. Обе фазы ограниченно устойчивы.
и 2 — 3. Эти неустойчивые состояния называются метастабильными. Участок 2 — 3 изображает перегретую жидкость, 5 — 6 — пересыщенный пар. Обе фазы ограниченно устойчивы.
|
|
|
При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8 — 9 на нижней изотерме соответствует перегретой жндкости, участок 9 — 10 — растянутой жидкости.
 2015-02-04
2015-02-04 331
331








