Выделение почвенных микроорганизмов на элективных питательных средах.
Теоретические пояснения:
В природе цикл азота состоит из нескольких этапов, основную роль в которых играют микроорганизмы, преимущественно бактерии. При этом только бактерии могут выполнять все реакции цикла. В этом участвует молекулярный азот и его связанные соединения – минеральные и органические (Рис. 17). Процессом фиксации атмосферного азота лимитированы все остальные звенья превращения азота.
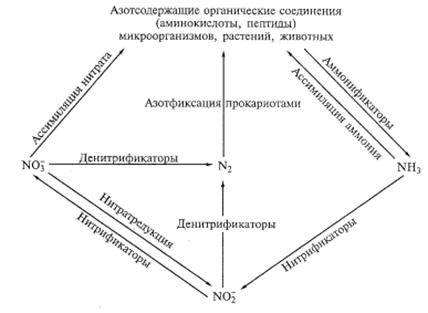
Рис.17. Глобальный цикл азота и микроорганизмы, участвующие в нем
(По Нетрусову, 2005)
Уникальные по своей метаболической способности азотфиксирующие микроорганизмы имеют ферментный комплекс – нитрогеназу, активирующую инертную молекулу атмосферного азота. Процесс восстановления молекулы азота до аммиака требует затраты больших количеств энергии и идет через ряд промежуточных продуктов. Образование нитрогеназы связано с наличием в клетках азотфиксирующих микроорганизмов nif-плазмиды, которая содержит nif-ген, регулирующий синтез этого белка. Передача nif-плазмиды от одного вида бактерий к другому может привести к появлению азотфиксирующей способности у новых видов микроорганизмов. Кислород репрессирует синтез нитрогеназы. Ее активность проявляется при низкой концентрации кислорода в газовой среде. Даже аэробные азотфиксаторы осуществляют процесс фиксации азота в микроаэробных условиях, для создания которых у них имеются различные защитные приспособления. Так, свободноживущий аэробный азотфиксатор Azotobacter образует слизь, препятствующую диффузии кислорода в клетки и тем самым созданию вокруг них микроаэробной зоны (Рис. 18).
|
|
|
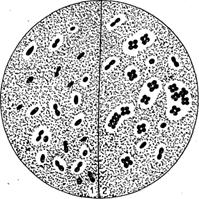
Рис. 18. Azotobacter: 1 - одиночные и двойные клетки с капсулами; 2 - сардинная форма с капсулой. Агар Эшби, тушь, фуксин
К тому же азотобактер часто находится в ассоциации с неазотфиксирующими аэробами, защищающими нитрогеназу азотобактера от доступа кислорода. Способность микроорганизмов фиксировать азот атмосферы и обогащать им почву нашла применение в сельском хозяйстве. На основе использования таких микроорганизмов, как клубеньковые бактерии и азотобактер, получают бактериальные удобрительные препараты нитрагин и азотобактерин. Биологическая фиксация азота в природе осуществляется свободноживущими и симбиотическими бактериями. Микроорганизмами, способными к симбиотической фиксации азота, являются бактерии рода Rhizobium.
К наиболее важным микроорганизмам, осуществляющим не симбиотическую фиксацию азота, относятся цианобактерии (Anabaena и Nostoc), Azotobacter, Beijerinckia, Bacillus polymyxa, Clostridium и др.
Денитрификация – это процесс восстановления нитратов до нитритов и далее до какой либо из газообразных форм азота (окиси азота, закиси азота, молекулярного азота).
|
|
|
NO3-→ NO2-→ NO-→ N2O→ N2
Способность к денитрификации обнаружена у многих почвенных и водных прокариот, среди них есть фото- и хемотрофы. Наиболее часто она встречается у грамположительных бактерий рода Bacillus, Micrococcus, грамотрицательных Pseudomonas (Рис.19).

Рис. 19. Денитрифицирующие бактерии. Среда Гильтая
Факультативные анаэробы, переключаются на денитрификацию в отсутствии кислорода. В присутствии кислорода характерно кислородное дыхание. В анаэробных условиях используют нитраты и нитриты как конечные акцепторы электронов при окислении органических субстратов для получения энергии. Серная бактерия Thiobacillus denitrificans восстанавливает нитраты в процесс окисления серосодержащих соединений. Выход энергии при денитрификации только на 10 % ниже, чем при кислородном дыхании. Денитрификация – одна из причин обеднения почв азотом и неполного использования растениями вносимых в почву азотных удобрений. Процесс имеет большое экологическое значение, так как восстанавливает баланс азота в атмосфере, являясь единственным источником азота в атмосфере.
Цель работы: выделить из почвы культуру аэробных азотфиксаторов и денитрификаторов и промикроскопировать.
Материалы и оборудование: питательная среда Эшби, колбы, пробирки, образцы почвы, стеклянные палочки, спиртовки, реактивы: 10% р-р хлорнокислого железа, чашки Петри.
Ход работы:
Культивирование аэробных азотфиксаторов
1. Приготовить питательную среду Эшби.
Состав питательной среды (в г на 1 л дистиллированной воды): маннит, или глюкоза, или сахароза – 20,0, К2НР04 — 0,2, MgSO4 — 0,2, NaCl — 0,2, K2SO4 — 0,2, СаСО3 — 5,0.
2. Среду разлить в колбы объемом 100-150 мл слоем 1–1,5 см, заразить почвой (1/2 чайной ложки) и поставить в термостат при температуре 28 °С.
3. Через 5–7 суток на поверхности среды образуется жирная пленка, сначала серовато-белая, а затем постепенно буреющая. Промикроскопировать клетки азотфиксирующих бактерий, подготовив прижизненный препарат из пленки.
4. Выявить капсулу методом негативного контрастирования. Для этого
каплю исследуемой культуры поместить в каплю разбавленного фуксина, а затем смешать с каплей туши и закрыть покровным стеклом. Тушь заполняет пространство, окружающее клетки, в результате чего хорошо видны не окрашивающиеся капсулы.
5. Сделать зарисовки.
Культивирование денитрификаторов
1. Приготовить питательную среду Гильтая. Раствор I: KNO3 – 2 г, аспарагин – 1 г, дистиллированная вода – 250 мл, раствор II: КН2РО4 — 2,0 г, МgSО4 — 2,0 г, СаСl2 — 0,2 г, FеСl3 — следы, лимоннокислый натрий — 5,0 г, дистиллированная вода – 500 мл. Растворы I и II слить, довести объем среды до 1000 мл дистиллированной водой.
2. По индикатору бромтимоловому синему установить pH 6,8- 7,2.
Среду разлить высоким слоем в большие пробирки и стерилизовать в автоклаве при 1 атм 20 мин.
3. Пробирки со средой заразить комочком почвы, закрыть плотно пробками и поместить в термостат при температуре 30–35°С. Для создания анаэробных условий поверхность жидкости в пробирках покрыть тонким слоем стерильного нейтрального масла.
4. Через 7–10 суток проанализировать среду. Отметить помутнение жидкости в пробирках, выделение газов (CO2 и N2). Нередко на среде с лимонной кислотой наблюдается позеленение жидкости в пробирке, что указывает на развитие бактерий Pseudomonas pyocyanea. Содержимое пробирки проверить на исчезновение нитратов и нитритов по качественной реакции с дифениламином и реактивом цинк-иод-крахмал и на появление аммиака в среде реактивом Несслера. Обычно после 6–7 суток инкубации пробы на нитраты и нитриты дают отрицательную реакцию, а проба на аммиак бывает положительной, что свидетельствует о восстановлении нитратов до аммиака.
|
|
|
5. Из жидкости, находящейся в пробирке, приготовить микропрепарат. В поле зрения микроскопа видна масса мелких палочковидных клеток, неспорообразующих, располагающихся одиночно, скоплениями либо в виде коротких цепочек.
6. Сделать зарисовки.
Вопросы для самоконтроля:
1. Что называется денитрификацией?
2. Какова роль ферментного комплекса нитрогеназы?
3. Какое значение имеют процессы денитрификации и азотфиксации в биосфере?
 2015-02-14
2015-02-14 6737
6737








