ШКОЛА МАТЕРИАЛОВЕДЕНИЯ
Тема 1
Современные представления о строении атома. Химическая связь и строение вещества. Вещества молекулярного и немолекулярного строения. Типы кристаллической решетки, зависимость свойств веществ от их состава и строения.
Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра, образованного протонами и нейтронами, и электронов.
Молекула – (лат. molecula, уменьшительное от moles – масса)
Ионы – (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд.
Катионы – положительно заряженные ионы.
Анионы – отрицательно заряженные ионы.
Химический элемент - это вид атомов с одинаковым положительным зарядом ядра.
Простые вещества – вещества, состоящие из атомов одного и того же химического элемента (например, кислород О2, озон О3, азот N2, золото Au).
Аллотропия – способность одного и того же элемента существовать в виде нескольких простых веществ (кислород и озон - аллотропные формы кислорода).
|
|
|
Сложные вещества состоят из атомов нескольких элементов (например, H2O, H2SO4, CH4).
Размеры и абсолютные массы атомов и молекул чрезвычайно малы, например:
Rат(H) = 3,7∙10-11 м mат(H) = 1,67∙10-27 кг
Rат(O) = 6,0∙10-11 м mат(O) = 2,67∙10-26 кг
Rат(Au) = 1,5∙10-10 м mат(Au) = 3,29∙10-25 кг
Для выражения масс атомов и молекул используют относительную атомную и относительную молекулярную массы.
Относительная атомная масса Аr (или просто атомная масса)- это число, показывающее, во сколько раз масса атома данного элемента больше атомной единицы массы (а.е.м.).
Относительная молекулярная масса Mr вещества - число, показывающее, во сколько раз масса молекулы данного вещества больше атомной единицы массы (а.е.м.).
Атомная единица массы (а.е.м.) равна 1/12 части массы атома изотопа углерода 12С.
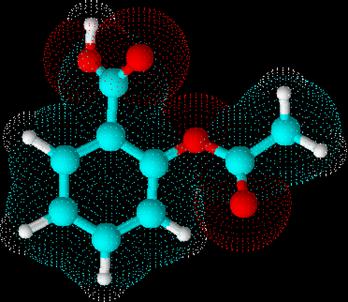
Модель молекулы аспирина
В зависимости от температуры и давления все вещества могут существовать в одном из четырех агрегатных состояний: твердом, жидком, газообразном или в виде плазмы. При низких температурах и высоких давлениях практически все вещества существуют в твердом агрегатном состоянии. Твердые вещества, как правило, имеют кристаллическое строение. Частицы, образующие кристалл, располагаются в правильном порядке в строго определенных точках пространства. Если мысленно соединить эти точки пересекающимися прямыми линиями, образуется пространственный каркас, который называют кристаллической решеткой. Точки, в которых расположены частицы (ионы, атомы или молекулы) называются узлами кристаллической решетки. В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от характера сил взаимодействия между ними различают молекулярные, атомные, ионные и металлические кристаллические решетки. Физические свойства веществ во многом определяются типом их кристаллической решетки и характером связи между частицами в кристалле. Характеристики веществ с различными типами кристаллических решеток приведены в таблице 1.
|
|
|

| 
|
| Кристалл поваренной соли NaCl | Ионная кристаллическая решетка NaCl |

| 
|
| Кристалл алмаза | Атомная кристаллическая решетка алмаза |
Таблица 1
Характеристики кристаллических решеток различных типов
| Тип кристалличес-кой решетки | Молекулярная | Атомная | Ионная | Металлическая |
| Частицы в узлах кристалличе-ской решетки | Молекулы | Атомы | Ионы | Атомы и катионы металлов |
| Характер сил взаимодей-ствия между частицами | Слабые межмолекулярные взаимодействия | Ковалентная связь | Ионная связь | Обобществленные валентные электроны – «электронный газ» |
| Характерные свойства веществ с данным типом решетки | Малая твердость, низкие температуры плавления, плохая растворимость. | Высокая твердость, высокие температуры плавления, хрупкость, отсутствие растворимости. | Высокие температуры плавления, высокая твердость, возможна растворимость в воде, растворы и расплавы проводят электрический ток. | Ковкость, пластичность, теплопроводность электропровод-ность. |
| Примеры веществ с данным типом решетки | Большинство органических веществ, многие неметаллы в твердом состоянии: сера, галогены, азот, кислород и др., твердый углекислый газ, галогеноводороды и др. | Алмаз, графит, кремний, кремнезем SiO2, карбид кремния SiC | Большинство солей, щелочи, оксиды металлов IА и IIА групп | Металлы, сплавы |
Задания с комментариями
1. Атомы 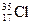
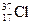 отличаются друг от друга
отличаются друг от друга
| 1) | числом протонов |
| 2) | числом нейтронов |
| 3) | зарядом ядра |
| 4) | числом электронов |
Комментарий: Атомы 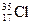
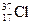 являются изотопами. Изотопы имеют одинаковый заряд ядра, одинаковое число протонов в его составе и одинаковое число электронов в электронной оболочке. Изотопы отличаются друг от друга количеством содержащихся в ядре нейтронов и, следовательно, имеют разную атомную массу. Ответ 2.
являются изотопами. Изотопы имеют одинаковый заряд ядра, одинаковое число протонов в его составе и одинаковое число электронов в электронной оболочке. Изотопы отличаются друг от друга количеством содержащихся в ядре нейтронов и, следовательно, имеют разную атомную массу. Ответ 2.
2. Сульфид-иону соответствует электронная формула
| 1) | 1 s 22 s 22 p 6 |
| 2) | 1 s 22 s 22 p 63 s 2 |
| 3) | 1 s 22 s 22 p 63 s 23 p 4 |
| 4) | 1 s 22 s 22 p 63 s 23 p 6 |
Комментарий: Сульфид-ион образуется при присоединении двух электронов атомом серы:
S +2 ē → S2-
Электронная конфигурация атома серы: 1 s 22 s 22 p 63 s 23 p 4, а электронная конфигурация сульфид-иона 1 s 22 s 22 p 63 s 23 p 6. Ответ: 4.
3. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
| 1) | Li ® Na ® K ® Rb |
| 2) | Li ® Be ® B ® C |
| 3) | Si ® Al ® Mg ® Na |
| 4) | C ® Si ® Ge ® Sn |
Комментарий: С увеличением атомного номера элемента в группе (т.е. при движении сверху вниз) радиус атомов растет. С увеличением атомного номера элемента в периоде (т.е. при движении слева направо) радиус атомов уменьшается. В соответствии с этими закономерностями уменьшение атомного радиуса происходит в ряду Li ® Be ® B ® C. Ответ 2
4. Соединением с ионной связью является
| 1) | CO |
| 2) | CsF |
| 3) | SCl2 |
| 4) | PH3 |
Комментарий: Ионная связь осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов, образованных, как правило, активным металлом и типичным неметаллом. В данном примере соединением с ионной связью является фторид цезия. Во всех остальных представленных в задании соединениях химическая связь осуществляется между атомами неметаллов и является ковалентной полярной. Ответ 2.
5. Химическая связь в молекулах брома и аммиака соответственно
|
|
|
| 1) | ковалентная полярная и металлическая |
| 2) | ионная и ковалентная полярная |
| 3) | ковалентная неполярная и ковалентная полярная |
| 4) | ковалентная неполярная и ионная |
Комментарий: Между атомами неметаллов образуется ковалентная связь. Если между собой связаны одинаковые атомы с равной электроотрицательностью, то ковалентная связь является неполярной. Если ковалентная связь образуется между атомами с разной электроотрицательностью, то она является полярной. Таким образом, в молекулах Br2 и NH3 образуются соответственно ковалентная неполярная и ковалентная полярная связи. Ответ: 3
6. К веществам молекулярного строения не относится
| 1) | хлор |
| 2) | оксид серы(IV) |
| 3) | иод |
| 4) | бромид калия |
Комментарий: Хлор, оксид серы(IV) и иод имеют молекулярную кристаллическую решетку и относятся к веществам молекулярного строения. Бромид калия имеет ионную кристаллическую решетку и не относится к веществам молекулярного строения. Ответ: 4
7. Вещества с молекулярной кристаллической решеткой характеризуются
| 1) | очень высокой твердостью |
| 2) | способностью проводить электрический ток |
| 3) | ковкостью и пластичностью |
| 4) | невысокими температурами плавления |
Комментарий: В молекулярной кристаллической решетке молекулы связаны между собой слабыми силами межмолекулярного взаимодействия. Поэтому вещества с этим типом кристаллической решетки характеризуются невысокими температурами плавления и кипения, хрупкостью, отсутствием способности проводить электрический ток. Ответ: 4
Выполнил _____________________________________________
(ФИО слушателя ЗШМ)
 2015-03-07
2015-03-07 3672
3672







