После изучения этой темы вы должны:
- иметь представление о следующих понятиях и величинах: ионное произведение воды, водородный показатель рН, гидролиз солей.
- освоить методы расчета значений рН для растворов кислот и оснований по их концентрациям и, наоборот, расчет концентраций по известному значению рН.
- уметь определять характер среды в водных растворах электролитов.
Вода – слабый электролит, диссоциирующий на катион водорода и анион гидроксила.
Н2О Û Н++ОН-. Константа диссоциации воды:
ß
Кд = 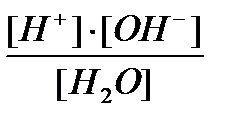 = 1,8.10-16; так как диссоциирует ничтожная часть молекул воды, то [H2O]~ постоянная величина, Кд.[H2O] = const = KH2O;
= 1,8.10-16; так как диссоциирует ничтожная часть молекул воды, то [H2O]~ постоянная величина, Кд.[H2O] = const = KH2O;
KH2O = [H+].[OH-] = 10-14, (при 250С).Эту величину называют - ионным произведением воды.
В разбавленных растворах электролитов (солей, кислот, щелочей) KH2O- постоянная величина. Зная [H+]., можно вычислять .[OH-] и наоборот.
При [H+] = [OH-]=10-7моль/л- среда нейтральная
При [H+] > [OH-], [H+]>10-7моль/л- среда кислая
При [H+] < [OH-], [H+]<10-7моль/л- среда щелочная.
Для характеристики среды раствора используют водородный показатель рН.
|
|
|
pН= -lg[H+], где [H+]-концентрация, моль/л
[H+] 100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10-10-11 10-12 10-13 10-14
моль/л увеличение кислотности увеличение щелочности
ß à
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
рН < 7 кислая среда рН = 7 нейтральная среда рН > 7 щелочная среда
Определить рН можно с помощью индикаторов (табл. 10).
Таблица 10
 2015-03-07
2015-03-07 1087
1087







