КЛЮЧЕВЫЕ СЛОВА: «ЛитАр», коллаген-апатитовый материал, кость, остеомиелитический дефект, регенерация
А.Ф. Краснов1, В.Ф. Глухов2,
С.Д. Литвинов3, А.В. Капишников1
ПРИМЕНЕНИЕ МАТЕРИАЛА «ЛитАр» ДЛЯ ЗАМЕЩЕНИЯ ПОСТОСТЕОМИЕЛИТИЧЕСКИХ ДЕФЕКТОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ
1Самарский государственный медицинский университет,
2Городская клиническая больница им. Н.И. Пирогова,
3Самарский государственный технический университет
ВВЕДЕНИЕ
Лечение хронического остеомиелита представляет собой одну из важнейших проблем в гнойной хирургии. При поражении длинных трубчатых костей лечебный процесс условно можно разделить на два этапа. На первом этапе проводится санация воспалительного очага в кости с целью максимального подавления воспалительного процесса, на втором – удаление зоны поражения с заполнением образовавшегося дефекта кости или секвестральной полости различными материалами. Особые трудности возникают в случаях сегментарных резекций кости, сопровождающихся образованием циркулярных дефектов кости, которые могут достигать значительных размеров. Оба этапа осуществляются или в ходе одной операции, либо второй этап откладывается на определенное время.
Проблема замещения циркулярных дефектов кости является одной из главнейших в восстановлении функции кости, предупреждение рецидива хронического остеомиелита. В последние годы стало возможным оптимизировать эту лечебную процедуру, используя более совершенные имплантационные биодеградируемые материалы.
МАТЕРИАЛ И МЕТОДЫ
В данном сообщении представлен опыт применения для замещения постостеомиелитических дефектов коллаген-апатитового композита "ЛитАр" (включен в государственный реестр медицинских изделий РФ. Регистрационное удостоверение № 29/13050501/3011-02 от 18.02.02). По химическим параметрам этот материал близок к минеральному составу костной ткани, не обладает антигенной активностью, не отторгается, в случае инфицирования в течение 7-10 дней полностью лизируется раневыми и микробными ферментами и поэтому не может являться субстанцией, длительно поддерживающей гнойный процесс. "ЛитАр" представляет собой смесь гидроксиапатита [Ca5(OH)(PO4)3] и ксеноколлагена, полученную не механическим путём. Специальная технология получения материала «ЛитАр» обеспечивает высокий уровень структурной интегрированности компонентов (пат. № 2053733 РФ от 10.02.96). Именно рост кристаллов гидроксоапатита на волокнах коллагена в ходе производства материала, т.е. получение солевого компонента в имплантате in situ, обеспечивает в дальнейшем высокую скорость лизиса материала «ЛитАр» в организме (содержание солевого компонента составляет 60 – 80% по весу). Если ауто-, аллокость резорбируются до года и более, то биотрансформация «ЛитАр» происходит за 15 – 20 дней, начиная с 3 – 5-го дня после операции. Высокая скорость биодеградации материала обеспечивается также его значительной пористостью, которая достигает 70%, что способствует васкуляризации имплантата в зоне операции за 12 – 15 дней (по данным морфологических исследований на животных) [8].
Качественно и количественно получаемый материал контролировался химическим, рентгенофазовым, дифференциальным термическим анализом, инфракрасной спектроскопией, компьютерной томографией, микробиологически, морфологически, и электронной микроскопией [3, 4].
В ходе биологических испытаний материала на животных (объем заполнения 0,3-0,5 см3) было установлено, что биодеградация композита в полости диафизарной части большеберцовой кости происходит в пределах 2-3 нед. При этом в зоне дефекта образовывалась соединительная ткань, которая со временем оссифицировалась (рис. 1), превращаясь в тип костной ткани, соответствующий анатомии замещенного участка кости [1].
"ЛитАр" неоднократно с успехом использовался для заполнения дефектов как длинных трубчатых костей, так и губчатой кости [9]. К его преимуществам относится простота в предоперационной подготовке, отсутствие необходимости в специальных условий хранения.
Методика применения "ЛитАра" при хроническом остеомиелите длинных трубчатых костей
В случае ограниченного остеомиелитического процесса мы производили секвестрэктомию по обычной методике с широким вскрытием секвестральной полости, удалением секвестров, гноя, грануляций до макроскопически здоровой компактной костной ткани. Полость заполнялась раствором антисептика в смеси с протеолитическим ферментом. Проводили ультразвуковую кавитация трижды по 5 - 7 мин с заменой раствора; затем в полость укладывался материал «ЛитАр» с суточной дозой антибиотика (чувствительность микрофлоры определялась во время предоперационной подготовки). Секвестральная полость дренировалась сквозным перфорированным трубчатым дренажем, проведенным через отдельно наложенное фрезевое отверстие или через доступ к секвестральной полости. Надкостницу ушивали. Мышцы и подкожная клетчатка дренировали по показаниям. Иммобилизация проводилась гипсовой лонгетной повязкой.
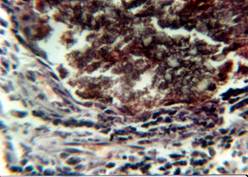
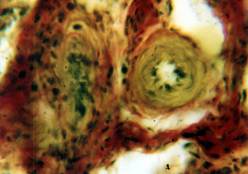
А б
Рис. 1. Морфологическая картина биоптата из большеберцовой кости собаки после имплантирования в трепанационное отверстие «ЛитАр».
а - через 12 дней: левый нижний угол – соединительная ткань, правый верхний – остатки «ЛитАра»; б – через 30 дней: оссификация соединительной ткани.
При циркулярном поражении участка длинной трубчатой кости проводили резекцию кости в пределах макроскопически здоровых тканей (желательно с сохранением надкостницы). Затем накладывался аппарат внешней фиксации. Предпочтение оказывалось спицевым аппаратам Илизарова. В отдельных случаях диастаз между костями уменьшали на 2 – 3 см (физиологически допустимое укорочение). Дефект кости заполнялся материалом «ЛитАр», пластины которого скручивались в виде трубок, а пространства между ними заполняли порошкообразным антибиотиком с учетом чувствительности микрофлоры. Дренирование осуществлялось трубчатым дренажем. Рану послойно ушивали наглухо.
Если поражение костного мозга распространялась от зоны поражения кости на значительное расстояние, проводился кюретаж костномозгового канала с последующим его дренированием перфорированным трубчатым дренажем и орошением растворами антибиотиков как фракционно (2-3 раза в сутки), так и проточно. Дренажи заводились в костномозговой канал через отдельные фрезовые отверстия. Проточное промывание продолжалось 5 – 6 дней.
В случаях, когда воспалительный процесс в зоне поражения не удавалось подавить до оперативного вмешательства, трансплантацию композита «ЛитАр» осуществляли через некоторое время. При первой операции производилась резекция пораженного отрезка длинной трубчатой кости, проводился кюретаж костномозгового канала с дренированием и проточным промыванием его. Накладывали аппарат Илизарова. Рану полностью не ушивали. Во время ежедневных перевязок, часто проводимых под наркозом, осуществляли санацию раны. По затихании воспалительного процесса, в условиях операционной производилось удаление грануляций в области костных фрагментов с последующим плотным заполнением диастаза материалом «ЛитАр» в смеси с антибиотиком, дренирование трубчатым дренажем и ушивание раны. При диастазе большеберцовой кости до 3,0 см и полном заживлении раны (30 – 35 дней после первой операции) из композита готовили кашицеобразная масса с антибиотиками, которую вводили в область диастаза кости через троакар под давлением.
Для замещения длинных костей, образовавшихся после их циркулярной резекции по поводу остеомиелита, «ЛитАр» применён у 31 больного. Протяженность дефектов составляла от 3 до 8 см, в одном случае достигла 10 см. срок наблюдения – до 4 лет. По локализации патологического процесса больные распределялись следующим образом: кости предплечья – 6 человек, плечевая кость – 4, большеберцовая – 18, бедренная – 3.
В качестве примера приводим одно из клинических наблюдений.
Больной С., 72 лет, переведен в отделение гнойной хирургии из травматологического отделения, где он лечился в течении 3-х нед. По поводу открытого оскольчатого перелома обеих костей левой голени в нижней трети (рис. 2, а). При поступлении в клинику больному выполнен экстрамедуллярной остеосинтез пластиной с фиксацией отдельных фрагментов большеберцовой кости шурупами (рис. 2, б). Послеоперационный период осложнился развитием посттравматического остеомиелита левой большеберцовой кости, пароссальной флегмоной. Температура тела 38 0С. Голень в нижней и средней трети отёчна в области операции гиперимирована.
При повторной операции металлическая пластина снята, отдельные шурупы удалены. Признаков консолидации не было.
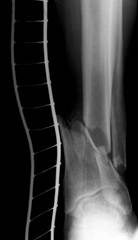
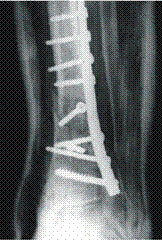
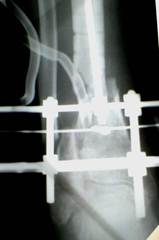
А б в
Рис. 2. Рентгенограммы левой голени больного С.: а – при поступлении в клинику; б – после экстрамедуллярного остеосинтеза; в – после удаления осколков и остеомиелитически изменённых участков кости, наложения аппарата Илизарова.
Пароссальные ткани отёчны, имеется свободный экссудат. Оба конца большеберцовой кости и отдельные фрагменты остеомиелитически изменены. После удаления пораженных участков кости и отдельных фрагментов образовался дефект в 4.5 см. Санация операционной раны проведен по полной программе, выполнен внеочаговый остеосинтез аппаратом Илизарова с уменьшением диастаза на 3,0 см (рис. 2, в). Рана частично ушита, дренирована трубчатым дренажём, через который осуществлялась промывание области операции раствором антисептиков с антибиотиками.
Через 10 дней, по стихании воспалительного процесса, края раны разведены, грануляции выскоблены, восстановлена анатомическая длина большеберцовой кости. Рана несколько раз промыта антисептиками с ультразвуковой обработкой. В области костного дефекта уложен свёрнутый рулоном материал «ЛитАр», пересыпанный 1,5 г сухого цефазолина. Рана ушита наглухо с дренированием трубчатым дренажем через отдельную контрапертуру. Произведена чрезкожная катетеризация левой бедренной артерии, в течение 8 дней осуществлялось внутриартериальное введение антибиотика. Послеоперационный период протекал достаточно спокойно. Температура не поднималась выше 37,7 0С и нормализовалась на 6-е сутки. Рана зажила первичным натяжением.
Компьютерная томография зоны дефекта с материалом «ЛитАр», проведённая через 2 нед. и через 4 мес., отчетливо показали динамику восстановления кортикального слоя в области дефекта (рис. 3). Данные КТ подтвердили, что на месте
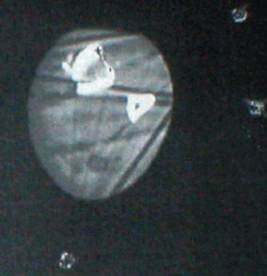
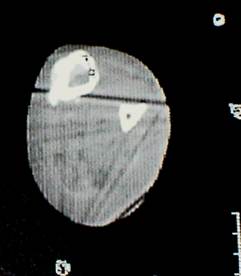
А б
Рис. 3. Компьютерные томограммы большеберцовой кости больного С.: а – через 14 дней после заполнения дефекта материалом «ЛитАр» (максимальная плотность + 47 Х); б – через 4 мес. (максимальная плотость + 392 Х).
имплантата «ЛитАр» появилась сначала соединительная, а затем и кальцифицированная (оссифицированная) ткань [7]. Спустя 5 мес. после операции на рентгенограмме отчётливо определялась трансформация имплантата в костную ткань (рис. 4). Опорная функция конечности восстановилась через 7 мес. При контрольном осмотре через 2,5 года: рецидива остеомиелита нет, больной полностью нагружает оперированную ногу, не испытывая каких-либо неприятных ощущений (рис. 5).
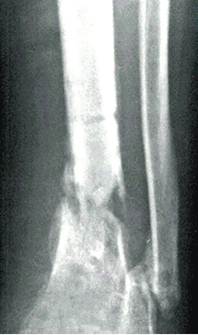
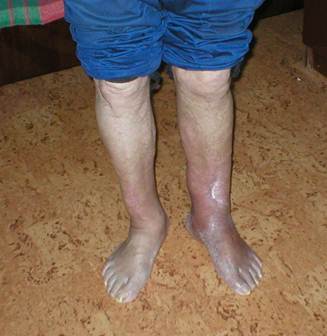
Рис. 4. Рис. 5.
Рис. 4. Рентгенограмма левой голени больного С. через 5 мес. после заполнения дефекта большеберцовой кости материалом «ЛитАр».
Рис. 5. Больной С. через 2,5 года после операции: опорная функция левой нижней конечности восстановлена полностью.
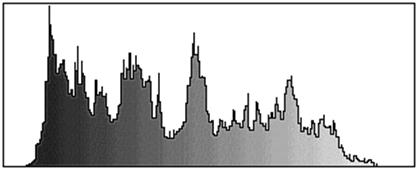
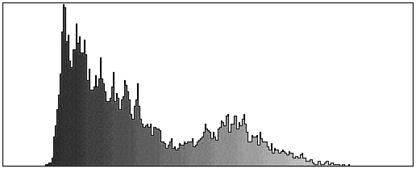
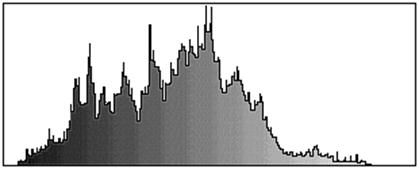
Для объективизации контроля биотрансформации «ЛитАра» (а именно это определяет успех лечения, особенно в случае инъекционного применения материала) мы использовали метод апостериорного компьютерного анализа рентгенограмм [5]. Динамика регистрируемых при этом гистограмм яркости объективно отражает изменение распределения плотности рентгеновского изображения в процессе трансформации пластического материала.
У описанного выше больного С. гистограмма области замещаемого дефекта, полученная непосредственно после операции (рис. 6, а) характеризовалась яркостным сигналом широкого диапазона, что соответствовало примерно одинаковому присутствию «мягкотканевой» и «костнотканевой» структур. Биодеградация материала «ЛитАр» наглядно отражается Через 8 дней на гистограмме этой же зоны (рис.6, б) распределение яркости заметно смещалось в сторону меньших плотностей («мягкотканевого» компонента). Через 3 мес. на гистограмме преобладали уровни высокой плотности (рис. 6, в), что указывало на формирование в зоне замещения дефекта костной ткани.
Аналогичный анализ, предпринят у больных с различной степенью выраженности воспалительного процесса в области операционной раны позволяет утверждать, что этапы восстановительного процесса в зоне дефекта кости во всех случаях были одинаковыми. Таким образом, проводя рентгенологические исследования с компьютерным анализом гистограмм яркости на разных этапах процесса возмещения дефекта кости, можно достаточно надёжно прогнозировать и оценивать эффективность регенерации, минимизируя время пребывания пациента в стационаре [2].
 а
а
 б
б
 в
в
Рис. 6. Гистограммы яркости рентгенограмм области дефекта большеберцовой кости больного С.
а – непосредственно после помещения в дефект материала «ЛитАр»; б – через 8 дней; в – через 3 мес.
 2015-03-08
2015-03-08 380
380







