Количественно диссоциация (ионизация) характеризуется степенью диссоциации (ионизации), которая равна отношению числа молей, продиссоциировавших молекул (Сдисс) к общему числу молей (Сисх) растворенного электролита и численно выражается в долях единицы или процентах(%):
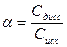 или
или 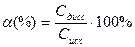
По способности к диссоциации электролиты разделяют на 3 группы:
1. сильные электролиты (α= 1, диссоциируют полностью). К сильным электролитам относят большинство солей (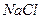 ,
, 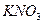 ,
, 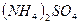 и др.), неорганические кислоты (
и др.), неорганические кислоты (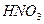 ,
, 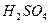 ,
, 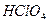 ,
, 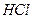 ,
, 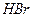 ,
, 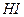 ) и щелочи (
) и щелочи (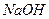 ,
, 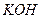 ,
, 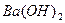 ,
, 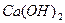 . Степень диссоциации составляет 30% и более процентов.
. Степень диссоциации составляет 30% и более процентов.
2. слабые (α<1, диссоциируют частично). Степень диссоциации слабых электролитов составляет менее 3%. К этой группе относят сероводородную, борную кислоты, карбонат натрия, гидроксид аммония и др.
3. электролиты средней силы. Характеризуются степенью диссоциации от3 до 30%. К этой группе относят фосфорную кислоту, сернистую, щавелевую, 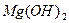 и некоторые соли тяжелых металлов.
и некоторые соли тяжелых металлов.
Для слабых электролитов степень диссоциации увеличивается с уменьшением концентрации (разбавлением) и увеличением температуры.
|
|
|
Степень диссоциации характеризует химическую активность электролитов. Например, хлороводородная кислота легко взаимодействует с металлическим цинком и быстро разлагает мрамор. Более слабая уксусная кислота медленнее взаимодействует и с цинком, и с мрамором. Многие, нерастворимые в уксусной кислоте соединения (сульфид цинка, оксалат кальция, хромат бария), легко растворяются в хлороводородной кислоте. Следовательно, чем выше степень диссоциации кислоты и ее концентрация, тем больше в растворе присутствует ионов водорода (протонов) и тем сильнее она в химическом отношении. Сила оснований также определяется степенью их диссоциации, т.е. концентрацией гидроксид-ионов.
Общая концентрация ионов в растворе сi определяется молярной концентрацией растворенного электролита (C, моль/л) с учетом его степени диссоциации (α) и числа ионов (m), на которые диссоциирует молекула электролита в растворе:
ci = m∙ α ∙C
Например, для 0,1 М раствора Al2(SO4)3 имеем:
Al2(SO4)3 → 2Al3+ + 3SO42- (α = 1)
c (Al3+) = 2∙1∙0,1 = 0,2 моль/л
c (SO42-) = 3∙1∙0,1 = 0,3 моль/л
 2015-03-20
2015-03-20 1922
1922








