φ0 – стандартный электродный потенциал металла при стандартных условиях (Т=298 К, [Mez+]=1моль/л) характеризует химическую активность металла, чем активнее металл, тем отрицательней его стандартный электродный потенциал;
R – универсальная газовая постоянная, R=8,314 Дж/(моль К);
Т- абсолютная температура, К;
z – число электронов, участвующих в электродном процессе;
F –число Фарадея, F= 96500 Кл;
[Mez+] – молярная концентрация ионов металла в растворе, моль/л.
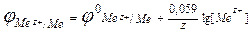 R=8,314 Дж/(моль К)
R=8,314 Дж/(моль К)
Т = 298 К
Измерение электродных потенциалов.
Стандартный водородный электрод
Измерить абсолютную величину электродного потенциала невозможно. Относительные значения измеряют в сравнении с некоторыми эталонными электродами - стандартными или электродами сравнения.
 2015-04-12
2015-04-12 416
416








