По закону Фарадея масса выделившегося на катоде вещества пропорциональна количеству электричества, прошедшего через раствор (расплав).
m = k ∙ Q,
где k – электрохимический эквивалент вещества, г/А∙ч; Q – количество электричества, прошедшего через раствор (расплав).
k = АMe/ nF,
где АМе – атомная масса металла, г/моль; n – число электронов, от-данных металлом на катоде; F – число Фарадея, F = 96500 Кл/моль.
Q = I ∙ τ ∙ η,
где I – сила тока, А; τ – время, с; η – выход по току, %.
Определяем силу тока, прошедшего через раствор:
I = 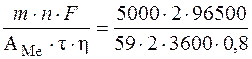 = 2839,6 A.
= 2839,6 A.
Пример 3.5. Рассчитайте массу гидроксида кальция (СаОН)2 необходимого для полного осаждения иона тяжелого металла Cr3+ с концентрацией 2,5 моль/л, содержащегося в ванне гальванического производства объемом 1 м3.
 2015-04-06
2015-04-06 1340
1340








