СИМВОЛЫ
j0Zn/Zn2+=-0,76B, j0Mg/Mg2+=-2,37B гальваникалық элементтiң (Zn0/Zn2+//Mg2+/Mg0) электр қозғаушы күшi: B) +1,61
DG0298 CаО=-604,2 кDж/моль; DG0298 CО2=-394,64 кDж/моль; DG0298 CаCО3=-1128,75кDж/моль. CаО(к)+CО2(г)=CаCО3(к) реакциясы бойынша стандартты жағдайда алынатын кальций карбонаты: A)-129,91; болады
DG0298HCl(г)=-95,3 кDж/моль, DG0298NH4Cl=-203,22 кDж/моль болғанда қалыпты жағдайда реакцияның өздігінен жүру мүмкіндігі: B) -91,44; жүредi
DS (ретсiздiк) энтропиясының өсуiмен жүретiн реакция: D) N2O(г)®2NO2(г)
[Н+]=1.10-4 болғанда ерiтiндiнiң рН-ы: A) 4
DНх.р.=-2360 кDж/моль; DН0298 Р2О5(г)=-1492 кDж/моль; DН0298 Н2О(с)=-285,8 кDж/моль болса, 2РН3(г)+4О2(г)=P2О5(г)+3Н2О(с) реакция теңдеуiн пайдаланып фосфиннiң (DН0298 РН3, кDж/моль) түзiлуi жылуын табыңыз: D) +5,3
DНх.р.=-28,42 кDж; DН0298 CО(г)=-110,4 кDж/моль; DН0298 CО2(г) =-393,1 кDж/моль. Fe2O3(к)+3CO(г)=2Fe(к)+3CO2(г) реакциясы бойынша темiр (III) оксидiнiң түзiлуi энтальпиясы: A)-819,7
“f”-электрон бұлты деңгейiндегi орбиталь саны: D) 7
ЦИФРЫ
0,01 М HNO3 ерiтiндiсiнiң рН мәнi: D) 2
0,01 М КОН ерiтiндiсiнiң рОН мәнiн есептеңiз. A) 2
0,01М CuSO4 ерiтiндiсiндегi мыстың электродтық потенциалы: j0Cu2+/Cu=+0,34 B. C) +0,28
0,01М ZnSO4 тұзы ерiтiндiсiндегi мырыштың электродтық потенциалы: (j0Zn2+/zn=-0,76B) C) -0,82
0,05 М күміс нитратының иондық күші: B) 5´10-2
0,1 М Na2CO3 –ң иондық күші: D) 0,3
0,1 М НCl –ң иондық күші: A) 0,1
0,25 М 1 л NaOH ерiтiндiсiнiң титрi: A) 0,01
0,25 моль молекулалық хлордағы хлордың атомдық саны: D) 1,51. 1023;
0,5 л 1Н Na2SO4 ерiтiндiсiн дайындау үшiн алынатын Na2SO4 массасы: C) 35,5
1 л ерітіндіде 6,3 г HNO3 (М = 63 г/моль) ерітілген. Осы ерітіндінің молярлық концентрациясы: B) 0,1
1 л ерітіндідегі еріген зат мөлшері: C) молярлық концентрация
1 л ерітіндідегі еріген заттың эквиваленттік мөлшері: D) нормальдық концентрация
1 литр ерiтiндiде 98 г H2SO4 болса (M H2SO4=98 г/моль) осы ерiтiндiнiң молярлық концентрациясы: C) 1 М
1 мл ерітіндідегі еріген заттың массасы(г): A) титр
1 сағ бойы AlCl3 балқымасынан 13,4 A. ток жiбергенде бөлiнетiн алюминийдiң массасы: A)4,5 г
100 г Н2О да 10 г глицеринді C3Н8О3 (МC3Н8O3=92 г/моль, КН2О=1,860C) еріткенде глицерин ерітіндісінің қату температурасының төмендеуі: B) - 2,02 0C
100 мл ерiтiндiде 3,4 г AgNO3 ерiтiлген. M(AgNO3 )=170 г/моль). Eрiтiндiнiң нормалдығы: A) 0,2
100 мл ерiтiндiде 49 г H2SO4 бар болса, осы ерiтiндiнiң нормальдығы: A)10
11,2 л көмiртегi (IV) оксидiнiң қалыпты жағдайдағы зат мөлшерi: B)0,5
160 г суда 40 г тұз ерiтiлген. Eріген заттың массалық үлесi (w, %): D) 20
2 литр құрамында 49 г H2SO4 бар. Осы ерiтiндiнiң нормальдық концентрациясы: (M (H2SO4)=98 г/моль) A) 0,5
2 моль хлордың (Cl2) қалыпты жағдайдағы көлемi: D) 44,8
20 %-тiк ерiтiндi дайындау үшiн 400 г суда ерітілетін NaNO3-тiң массасы: D) 100г
200 г Н2О да 40 г қантты C12Н22О11 (МC12H22O11 = 342 г/моль, EН2О=0,520) еріткендегі қант ерітіндісінің қайнау температурасының жоғарылауы: A) 100,3 0C
235U реттік нөмірі 92, нейтрон саны: C) 143;
250 г суда 54 г глюкоза (C6H12O6) ерiтiлген. Осы ерiтiндi қату температурасы: B)-2,23
250 мл ерiтiндiде 10,5 г натрий фторидi бар. Осы ерітіндінің нормалдық концентрациясы (MNaF=42 г/моль): C) 1
250C температурада 0,5 М глюкозà (C6Н12О6) ерітіндісінің осмос қысымы неге тең? B) 1,24
2A2(г)+B2(г)=2A2B(г)-реакциядағы A-заты концентрациясын 4 есе төмендету нәтижесiнде тура және керi реакция жылдамдығы өзгермеуi үшiн B2 заты концентрациясының еселігі: B) 16 есе
2CO(г) +O2 (г) Û 2CO2 (г)+Q жүйесiндегi тепе-теңдiктi солға, яғни бастапқы заттар жағына ығыстыру үшiн: D) температураны өсiредi
2NO(г)+O2(г)Û 2NO2(г) жүйесiндегi қысымды 4 есе өсiргенде реакция жылдамдығының еселік өзгерісі: E) 64
2NO(г)+O2(г)=2NO2(г)  реакцисының қысымын 4 есе арттырғандағы жылдамдығы: D) 64 есе
реакцисының қысымын 4 есе арттырғандағы жылдамдығы: D) 64 есе
2NO+O2«2NO2+Q-реакция тепе-теңдiгi солға қарай ығысуына қажетті жағдай: B) температураны көтергенде
2SO2(г)+O2(г)Û 2SO3(г) жүйесiнiң қысымын 2 есе азайтқандағы реакция жылдамдығының еселік өзгерісі: A) 8 есе өседi
30 г бейэлектролит 500 г суда ерiтiлген. КН2О=1,860C. Eрiтiндi –1,860C-та қатады. Eрiтiлген заттың молекулалық массасы: B) 60
3H2(г)+N2(г) Û 2NH3(г) жүйесiндегi тепе-теңдiктi оңға, яғни аммиак түзiлу жағына ығыстыру үшiн: A)қысымды өсiредi
3H2(г)+N2(г)®2NH3(г) реакциясының сутегi концентрациясын 2 есе өсiргенде жылдамдығының еселік өзгерісі: D) 8
4 квант саны бірдей 2 электрон болуы мүмкін емес: C) Паули ұстанымы
400 мл 0,1 н күкірт қышқылының ерітіндісін дайындау үшін алынатын H2SO4 массасы: E) 1,96 г
44,5 г AlCl3 –гі хлор атомының саны: B) 6,02 . 1023;
4HCl(г)+O2(г)®2H2O(г)+2Cl2(г) реакциясындағы HCl концентрациясын 2 есе өсiргенде жылдамдықтың өзгеру еселігі: D) 16
4NН3(г)+5NO2(г)=4NO(г)+6H2O(Бу) жүйесiнiң қысымын 2 есе өсiргенде реакция жылдамдығының еселік өзгерісі: E) 512
5,0 г затты 200 г суда еріту нәтижесінде электр тогын өткізбейтін және кристалдану температурасы -1, 45 тең ерітінді алынды. Осы кездегі еріген заттың молекулалық массасы: D) 32
5,6 г күкiрт темiрмен қосылғанда (Fe+S=FeS) 17,59 кDж жылу бөлiнген. Темiр сульфидiнiң түзiлу жылуы: D) 175,9 кDж/моль
5,6 л азот оксидiнiң (NO) қ.ж. зат мөлшерi (n): C)0,25 моль
500 мл 0,25 Н Na2CO3 ерiтiндiсiндегі Na2CO3 –ң массасы: B) 6,625
6,02*1024 атом санына сәйкес азоттың көлемi (қ.ж.): C) 224 л
7 топта орналасқан элементке сәйкес келетін электрондық формула: E)...6s24f145d106p5
80 г электролит емес зат 2 кг суда (Н2О) ерiтiлген. Бұл заттың молярлық массасы 80 г/моль. KH2O=1,860. Осы жағдайдағы ерiтiндiнiң қату температурасы: D) -0,930
A) CaO DH0 f, 298= -635,5 кDж/моль
БУКВЫ
AAAAAAA
A2(г)+B2(г) Û 2AB(г) – тура реакцияның температуралық коэффициентi 2-ге, керi реакцияның 3-ке тең. Бiр уақытта қысымды 2 есе, температураны 100C-ке арттырса, реакцияның тепе-теңдiгiнің ығысуы: A) солға қарай
AB2-типтi сызықтық формадағы молекула: A)CaCl2
AgNO3 ерiтiндiсiн электролиздегенде анод маңында концентрленетін зат: D) O2
AgNO3 ерiтiндiсiнен массасы 108 г күмiстi 6 мин. ішiнде бөлiп алу үшiн жұмсалатын ток күшi: A)268 A
AgNO3 тұзының ерiтiндiсiнен 1,5 A токты 1 мин бойы жiбергенде катодта бөлiнетiн күмiстiң массасы: E)0,1 г
AuCl3 ерiтiндiсiн 30 минут бойы электролиздегенде катодта 0,5 г Au бөлiну үшiн қажеттi ток күшi: C) 0,4A
AuCl3 және KCl ерiтiндiсiнiң қоспасын электролиздегенде, электродта бөлiнетiн заттар: D) Au және Cl2
Aзоттың төменгi және жоғарғы тотығу дәрежесi: A) -3; +5
Aктивтілігі жоғарысы:
Aлтын атомы ядросындағы нейтрон саны 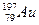 : D) 118
: D) 118
Aлюминий атомының (
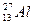 )электрондық формуласы: B) 3s23p1
)электрондық формуласы: B) 3s23p1
Aлюминий катионындағы Al3+ электрондар саны (
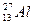 ) E) 10
) E) 10
Aмфотерлi гидроксидтер орналасқан қатар: B) Be(OH)2, Zn(OH)2, Cr(OH)3
Aуа бойынша газдың салыстырмалы тығыздығы 1,5 кезіндегі газдың молярлық массасы (Мауа=29 г/моль): C) 44
 2015-04-30
2015-04-30 606
606







