1.1. Основные понятия и определения
Техническая термодинамика – наука, изучающая процессы преобразования теплоты в работу в тепловых машинах, а также свойства тел, посредством которых осуществляются указанные преобразования.
Различные физические тела, особенно газообразные, при нагревании расширяются, что и лежит в основе принципа действия тепловых двигателей. Вещество, посредством которого, осуществляется преобразование теплоты в работу в технической термодинамике, называется рабочим телом (р.т.).
Термодинамическая система (т.д.с.) – это совокупность материальных тел, являющихся объектом изучения, находящихся в тепловом или (и) механическом взаимодействии с другими телами, которые называются окружающей средой (о.с).
Поверхность, отделяющая рабочее тело термодинамической системы от окружающей среды называется граничной.
В зависимости от свойств, граничной поверхности различают:
· изолированную т.д.с. - граничная поверхность не допускает, ни теплового, ни механического взаимодействия рабочего тела термодинамической системы с окружающей средой;
|
|
|
· полуизолированную т.д.с. - граничная поверхность допускает или тепловое или механическое взаимодействие рабочего тела термодинамической системы с окружающей средой;
· неизолированную т.д.с.- граничная поверхность допускает и тепловое и механическое взаимодействие рабочего тела термодинамической системы с окружающей средой;
· закрытую т.д.с.- граничная поверхность не допускает обмена массы рабочего тела термодинамической системы с окружающей средой;
· открытую т.д.с.- граничная поверхность допускает обмен массы рабочего тела термодинамической системы с окружающей средой.
Требования, предъявляемые к рабочему телу т.д.с.:
§ должно обладать хорошими теплопроводящими свойствами, то есть должно быстро нагреваться или охлаждаться;
§ должно хорошо деформироваться;
§ должно быстро занимать или освобождать представленный ему объем.
Наиболее полно указанным требованиям удовлетворяют газы. Для упрощения математического аппарата при проведении расчетов в технической термодинамике, рассматривается идеальный газ.
Молекулы идеального газа обладают следующими свойствами:
- имеют исчезающе малый объем, то есть представляют собой материальные точки, обладающие одинаковыми массой и размерами;
- не вступают в химическое взаимодействие между собой;
- между молекулами отсутствуют силы притяжения и отталкивания;
- при взаимодействии ведут себя, как абсолютно упругие шары.
Состоянием т.д.с.- называется совокупность физических величин, характеризующих систему в данный момент времени. Физические величины т.д.с., не изменяющиеся в процессе ее взаимодействия с окружающей средой, называются константами системы, а изменяющиеся – ее параметрами. Различают равновесное и неравновесное состояние систем.
|
|
|
Состояние системы называется равновесным, если ее параметры одинаковы в каждой точке объема, в противном случае – неравновесным.
Тепловая машина, совершающая работу за счет получаемой извне теплоты, называется тепловым двигателем. Тепловая машина, в которой теплота переходит от тела с меньшей температурой к телу с большей температурой за счет затрачиваемой извне энергией, называется холодильной машиной.
1.2. Рабочая P-v и тепловая T-S диаграммы
Теплота (Q, Дж) - вид энергии, обусловленной хаотическим движением частиц вещества и наличием разности температур.
Работа (L, Дж) - энергия, передаваемая от одного тела к другому в форме направленного движения.
Работа и теплота связаны между собой следующей зависимостью (первый закон термодинамики):
dQ = dU + dL - для M массы рабочего тела,
dq = du + dl - для единицы массы рабочего тела,
где du - относительное изменение внутренней энергии т.д.с., Дж/кг.
Равновесное состояние т.д.с. графически изображается точкой в трехмерной P-v-T и двумерной P-v диаграммах (v - удельный объем, м3/кг). Процесс взаимодействия т.д.с. с окружающей средой в таких диаграммах, как правило, представляется в виде кривой линии.
На практике в силу особенностей математического характера, обычно используется P-v диаграмма, рис.1.1.
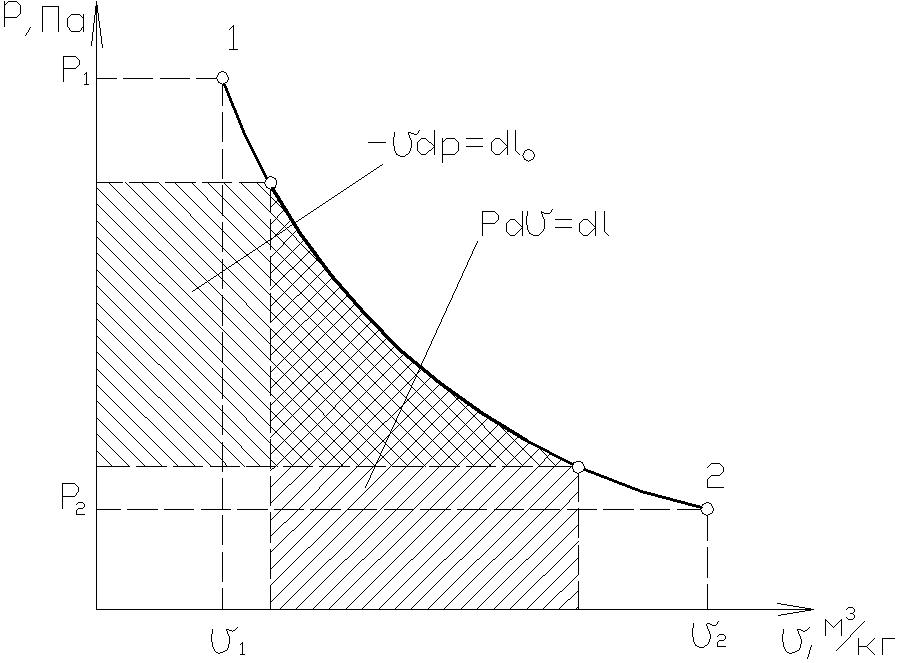
Рис. 1.1.
Работа деформации:
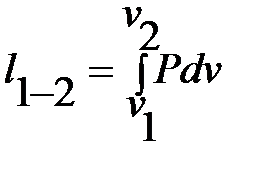 =площадь v112v2, dv >0, dl >0; dv <0, dl <0;
=площадь v112v2, dv >0, dl >0; dv <0, dl <0;
Располагаемая работа:
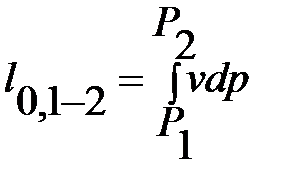 =площадь P2P112, dP >0, dl0 <0; dP <0, dl0 >0;
=площадь P2P112, dP >0, dl0 <0; dP <0, dl0 >0;
Работа перемещения:
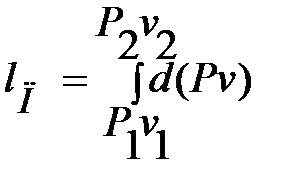 .
.
Диаграмма P-v называется рабочей, так как площадь под кривой в масштабе диаграммы численно равна работе газа в рассматриваемом процессе.
В термодинамике большую роль играет такая функция состояния вещества, как энтропия, S:
dS=dq/T, Дж/(кг×К).
Энтропия характеризует меру вероятности протекания термодинамического процесса в изолированной системе:
dS=dq/T=CndT/T.
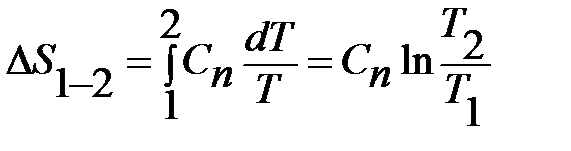 ,
,
где Cn – удельная теплоемкость газа в произвольном термодинамическом процессе:
Cn=dq/dT, Дж/(кг×К).
При анализе открытых термодинамических систем удобно использовать понятие – энтальпии:
i=u+Pv, Дж/кг.
Первый закон термодинамики:
dq=du+dl,
с учетом выражения для энтальпии может быть представлен в следующем виде:
dq=di-d(Pv)+dl=di-Pdv-vdP+Pdv=di+dl0.
В изобарном процессе изменение энтальпии равно количеству тепла, поглощенного или отданного т.д.с., то есть характеризует теплосодержание ее рабочего тела:
di=CPdT.
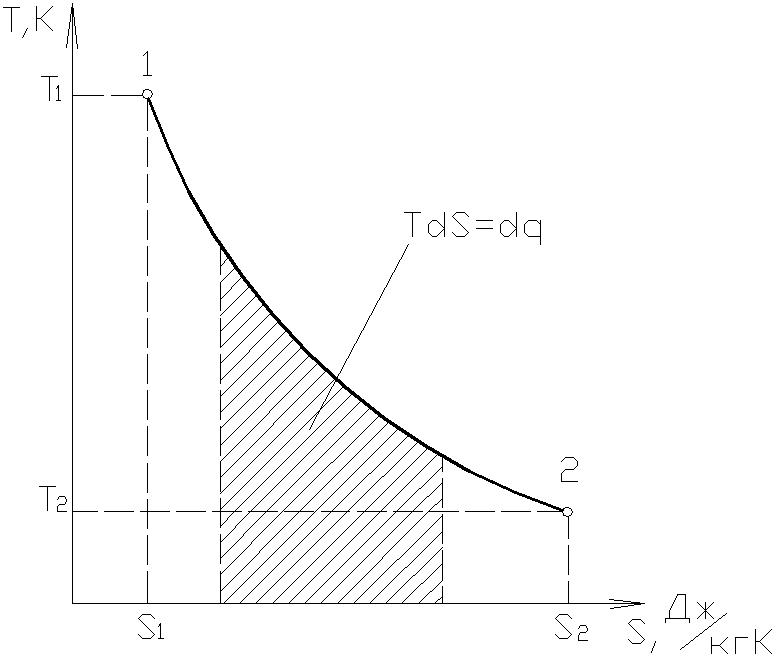
Диаграмма T-S называется тепловой, так как площадь под кривой в масштабе диаграммы численно равна количеству тепла, поглощенного или отданного рабочим телом, рис. 1.2.
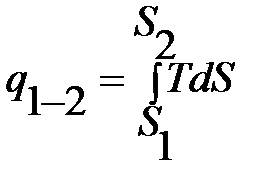 =площадь S1S212.
=площадь S1S212.
|
Рис. 1.2.
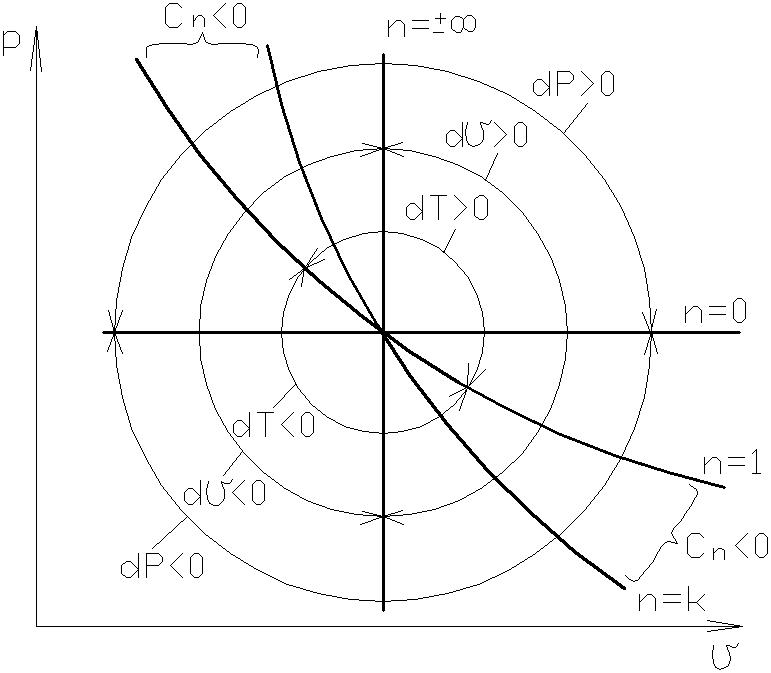
1.3. Обобщающее значение политропного процесса
Политропным называется процесс, происходящий в идеальном газе при постоянной удельной теплоемкости, уравнение которого описывается следующим выражением:
Pvn=const,
где n = показатель политропы процессы.
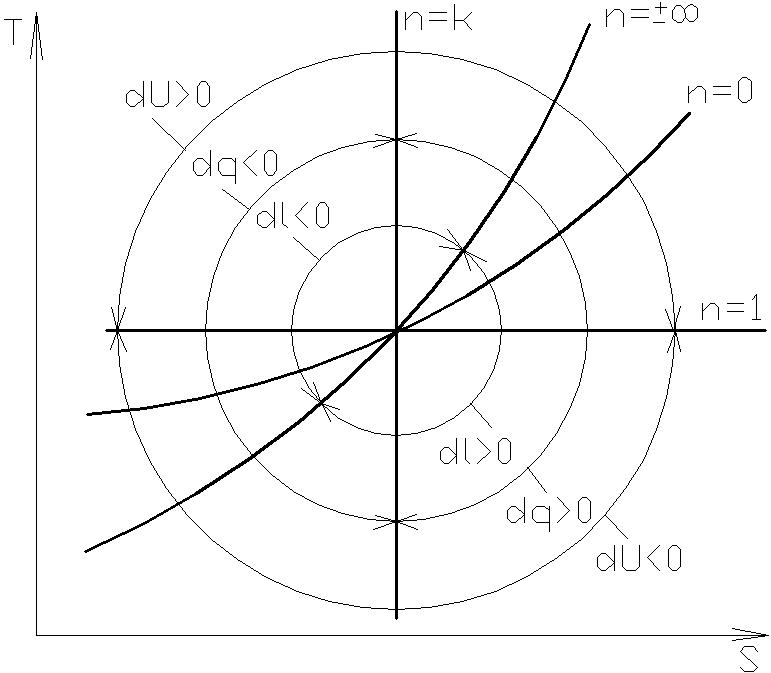
Различают следующие частные случаи политропного процесса, рис. 1.3.
n=0; P=const; C=Cp – изобарический процесс;
n=1; T=const; C=±¥ - изотермический процесс;
n=±µ; v=const; C=Cv – изохорический процесс;
n=k=Cp/Cv; q=const; C=0 – адиабатический процесс.
| а) |
| б) |
Рис. 1.3.
При увеличении объема изохора в T-S диаграмме (логарифмическая зависимость) эквидистантно смещается вправо вдоль оси абсцисс, при этом площадь под кривой процесса в масштабе диаграммы численно равно изменению внутренней энергии в процессе q=Du.
При увеличении давления изобара в T-S диаграмме (логарифмическая зависимость) эквидистантно смещается влево вдоль оси абсцисс и проходит более полого, чем изохора.
|
|
|
При увеличении температуры изотерма в P-v диаграмме (равнобокая гипербола) эквидистантно смещается вверх; причем площадь под кривой процесса в T-S диаграмме численно равно располагаемой работе и работе деформации:
q = l0 = l.
При увеличении энтропии адиабата в P-v диаграмме (равнобокая гипербола) эквидистантно смещается вверх и проходит более круто, чем изотерма.
 2015-05-06
2015-05-06 5668
5668