Изотермический процесс предполагает идеальный теплообмен с окружающей средой, температура которой в любом процессе принимается неизменной. В адиабатном процессе теплообмен со средой полностью отсутствует. В действительности оба этих предельных случая не могут быть полностью осуществлены. В связи с этим вводят более общий, так называемый политропный процесс, используя для этой цели уравнение
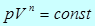 (34)
(34)
где 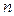 - постоянная величина, называемая постоянной политропы; она может принимать значения от
- постоянная величина, называемая постоянной политропы; она может принимать значения от 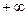 до
до 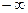
Получим уравнение (34). Напишем первый закон термодинамики в двух видах
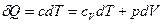 и
и 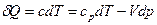 (35)
(35)
Из этой системы следует 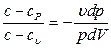
Обозначив 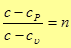 (36)
(36)
имеем 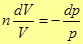 (37)
(37)
Интегрируя это соотношение при 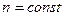 , получим
, получим
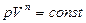 (38)
(38)
Это выражение называется уравнением политропного процесса.
Учитывая, что 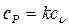 , из (36) можно получить формулу теплоемкости
, из (36) можно получить формулу теплоемкости 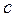 в политропном процессе
в политропном процессе
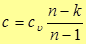 (39)
(39)
На рис. 2 приведен график функции 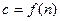 (выражение 39)
(выражение 39)
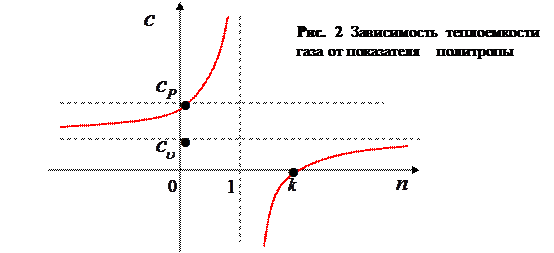
В зависимости от величины 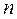 политропный процесс может быть, в частности, изотермическим, изобарным, изохорным, адиабатным
политропный процесс может быть, в частности, изотермическим, изобарным, изохорным, адиабатным
|
|
|
1) при 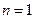 уравнение (50) превращается в уравнением изотермического процесса
уравнение (50) превращается в уравнением изотермического процесса
2) при 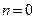 из (50) получаем уравнение изобарного процесса
из (50) получаем уравнение изобарного процесса
3) при 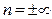 уравнение (50) можно записать в виде
уравнение (50) можно записать в виде 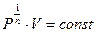 из которого следует
из которого следует 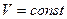 , т.е. получили изохорный процесс.
, т.е. получили изохорный процесс.
4) при 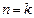 выражение (50) переходит в уравнение адиабатного процесса.
выражение (50) переходит в уравнение адиабатного процесса.
1) при 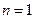 (изотермический процесс) теплоемкость стремится к бесконечности
(изотермический процесс) теплоемкость стремится к бесконечности 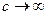
2) при 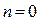 (изобарный процесс)
(изобарный процесс) 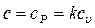
3) при 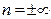 (изохорный процесс)
(изохорный процесс) 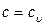
4) при 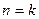 (адиабатный процесс)
(адиабатный процесс) 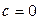
Приведем формулы связи между параметрами состояния идеального газа в политропном
процессе
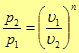
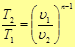
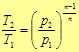 (40)
(40)
 2015-05-06
2015-05-06 933
933








