1. Что такое скорость химической реакции?
2. Какие факторы влияют на скорость химической реакции?
3. Как на скорость химической реакции влияет концентрации реагирующих
веществ, температура, давление, присутствие катализатора?
4. Чем характеризуется состояние химического равновесия?
5. Как определить величину константы химического равновесия?
6. Может ли смещаться химическое равновесие?
7. Сформулируйте принцип Ле-Шателье о смещении химического равновесия.
8. Какие факторы и каким образом влияют на смещение химического равновесия?
9. Как изменится скорость химической реакции, если температура в системе
увеличится на 30°С, а температурный коэффициент у = 3,0?
10.Укажите правильное выражение для скорости (кинетическое уравнение) химической реакции' 2А+ЗВ→2С
a. V=k[A]2[B]3
b. V=k[A]2+[B]3
c. V=[A]2[B]3
d. V=k[A]2[B]3[C]2
e. V=k2[A]3[B]
11.Как изменится скорость химической реакции 2NO + О2 = 2NO2, если
концентрацию вещества NO2 увеличить в 7 раз?
12.Найти константу равновесия и исходные концентрации веществ в реакции
|
|
|
2NO+O2↔2NO2. Равновесие установилось при следующих концентрациях
реагирующих веществ: [NO]=0,02 моль/л, [О2]=0,3 моль/л, [NO2]=0,06
моль/л.
13.В каком направлении сместится равновесие в системах
2СО(Г) + О2(г) =2СО2(г) - 566кДж
N2(г)+ O2(г) = 2NO(г) + 180 кДж
при понижении температуры и при повышении давления?
РАЗДЕЛ 5 РАСТВОРЫ
ТЕМА 5.1 ХАРАКТЕРИСТИКА РАСТВОРОВ
Растворы имеют важное значение в жизни и практической деятельности человека. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.) Все производства в той или иной мере связаны с использованием различных растворов.
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в довольно широких пределах. Наиболее важный вид растворов - это жидкие растворы.
Всякий раствор состоит из растворенного вещества и растворителя, т.е. среды, в которой это вещество равномерно распределено в виде молекул или более мелких частиц - ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если оба компонента до растворения находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве. Однородность растворов делает их сходными химическими соединениями. Выделение тепла при растворении некоторых веществ тоже указывает на известного рода химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав последних постоянен, а состав раствора может изменяться в довольно широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, однако от последних они резко отличаются своей однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
|
|
|
Образование раствора идет самопроизвольно и необратимо вплоть до состояния устойчивого равновесия (насыщенного раствора). Насыщенный раствор - это такой раствор, который может неопределенно долго оставаться в равновесии с избытком растворяемого вещества. Движущей силой процесса растворения является уменьшение свободной энергии раствора ДО по сравнению со свободной энергией исходных составных частей раствора. При растворении
∑ΔG прод-∑ΔGисход< 0.
Если процесс растворения закончился, система пришла к состоянию равновесия
ΔG=0.
Энергетической характеристикой процесса растворения является энтальпия образования раствора ΔН, которая при образовании раствора либо падает, либо возрастает. При растворении газов энтальпия возрастает. Растворение жидких и твердых веществ может сопровождаться как уменьшением, так и возрастанием энтальпии. При образовании растворов значительно изменяется и энтропия ΔS. Она возрастает всякий раз, когда растворение сопровождается увеличением объема по сравнению с исходными компонентами, и падает, когда объем уменьшается. При растворении газов в жидкости энтропия всегда уменьшается, а при растворении кристаллических тел возрастает.
Растворимость веществ зависит от природы растворенного вещества, природы растворителя, концентрации раствора и температуры. Для газообразных веществ она существенно зависит от давления. Абсолютно нерастворимых веществ в природе нет.
ТЕМА 5.2 СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами - долями или процентами, либо величинами размерными - концентрациями.
1. Массовая доля - процентное отношение массы растворенного вещества к
общей массе раствора. При этом масса всего раствора всегда принимался за
100%, а процентное содержание растворенного вещества W находится из
пропорции или по формуле
W = mвещества* 100%/(mрастворителя+ mвещества)= mвещества*100%/mраствора
Процентная концентрация показывает также массу растворенного вещества (в граммах) на каждые 100 г раствора.
2. Мольная доля Ni. - отношение количества растворенного вещества (или
растворителя) к сумме количеств всех веществ, находящихся в растворе.
Например, в системе, состоящей из растворителя и одного растворенного
вещества, мольная доля последнего равна
N2 = n2/(nl+n2),
а мольная доля растворителя равна
N1=n1/(n1+n2),
где n1, n2 - соответственно количество вещества растворителя и растворенного вещества.
3. Молярная концентрация См показывает количество молей растворенного
вещества в 1л раствора и рассчитывается по формуле
С = mB/ (M*V),
где М- молярная масса растворенного вещества, г/моль; V - объем раствора, л; mB - масса растворенного вещества, г. Отношение количества растворенного вещества к объему раствора выражается в моль/л. Обозначается, например: 1,5 М или См=1,5 моль/л.
4. Моляльная концентрация или моляльность m показывает количество
молей растворенного вещества в 1000г растворителя.
5. Эквивалентная концентрация или нормальность Сн или н показывает
число эквивалентов растворенного вещества в 1л раствора.
|
|
|
Пример: в 250 г воды растворено 50г кристаллогидрата FeSO4*2H2O. Вычислить массовую долю кристаллогидрата.
Решение:
W = mвещества* 100%/(mрастворителя+ mвещества)= mвещества*100%/mраствора
W =(50/(50+250))*100%=16,7%.
Пример: чему равна молярная концентрация раствора, если в 2 литрах раствора содержится 120 грамм вещества MgSO4 (М=120 г/моль)?
Решение: находим количество молей n сульфата магния, содержащихся в 120 граммах
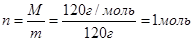
где М – молекулярная масса вещества, г/моль; m – масса вещества, г.
По условию задачи в 2 литрах раствора содержится 1 моль сульфата магния, тогда в 1 литре раствора содержится 0,5 молей MgSO4, т.е.
См=0,5 моль/л.
ТЕМА 5.3 ОБЩИЕ СВОЙСТВА РАСТВОРОВ
Растворы замерзают при более низкой, а кипят при более высокой температуре по сравнению с чистым растворителем. Количественная зависимость понижения температуры замерзания
Δtзам=К*m,
Δtкип=Е*m,
Где m – моляльная концентрация, Е и К – эбулиоскопическая и криоскопическая константы, зависящие от природы растворителя. Например, для воды К=1,86, Е=0,52. Данные формулы можно использовать для определения молекулярных масс растворенных веществ. При этом они используются в виде
Δtзам = K*g*1000/(M*G),
Δtкип =E*g*1000/(M*G),
где g и G - массы растворенного вещества и растворителя; М -молекулярная масса растворенного вещества.
Пример: рассчитать, при какой температуре должен кристаллизоваться раствор, содержащий в 250г воды 54 г глюкозы С 6H12О6.
Решение: при перерасчете на 1000 г воды содержание глюкозы в растворе равно 54*4=216г. Так как мольная масса глюкозы составляет 180г/моль, то моляльность раствора равна m=216/180=1,2 моля на 1000г воды. По формуле
Δtзам=К*m
находим
Δtзам =l,86* 1,20=2,23 К.
Следовательно, так как
Δtзам = tзам(воды)- tзам(раствора), то
tзам(раствора)= tзам(воды - Δtзам =273K-2,23K=271,23К= - 2,23°С.
Пример: раствор, содержащий 8г некоторого вещества в 100 г диэтилового эфира, кипит при 36,86°С, а чистый эфир кипит при 35,6°С. Определить молекулярную массу растворенного вещества.
Решение: находим, что
Δtкип = 36,86-35,6=1,26 градуса.
Тогда, из уравнения
Δtкип =E*g*1000/(M*G)
находим; что
|
|
|
M=E*g*1000/(G*Δtкип)= 2,02*8*1000/(100*1,26)=128,2г/моль.
Раствор - однородная система. Это означает, что концентрация растворенного вещества в любом объеме остается неизменной во времени. Неизменность обусловлена тем, что число выходящих и входящих в этот объем молекул растворителя и растворенного вещества одинаково. Выделенный объем находится в динамическом равновесии с окружающей средой.
Возьмем сосуд с разбавленным раствором сахара, дно которого сделано из специального материала, проницаемого для молекул растворителя и непроницаемого для молекул растворенного вещества, и посмотрим, что произойдет, если этот сосуд опустить в стакан с водой.
Молекулы растворителя из объема с их большей концентрацией (из чистой воды) будут перемещаться через полупроницаемую перегородку в водный раствор сахара, где их концентрация меньше.
Явление односторонней диффузии растворителя через полупроницаемую перегородку называется осмосом. Сила, действующая на единицу поверхности, препятствующая молекулам растворителя проникать через полупроницаемую перегородку, получила название осмотического давления.
Осмотическое давление Р прямо пропорционально концентрации растворенного вещества и абсолютной температуре раствора
P=CMRT,
где См - молярная концентрация, R - газовая постоянная, Т - абсолютная температура. Используя данную формулу, можно находить молекулярную массу растворенных веществ.
Осмотическое давление, подобно давлению газа, при постоянных объеме и температуре зависит только от числа молекул растворенного вещества, но не зависит от природы растворенного вещества и растворителя.
Закон Вант-Гоффа: осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещества, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Пример: рассчитать осмотическое давление раствора, содержащего в 1-ом литре 9г глюкозы (С 6H12О6) при температуре 25°С.
Решение: молекулярный вес глюкозы 180г/моль. Следовательно, 9г составляет 0,05 моля, то есть См=0,05 моль/л. Тогда
Р=0,05 моль/л*8,31 Дж/моль*К*298 К= 123,8 кПа.
ТЕМА 5.4 СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Электролитами называются вещества, которые в растворе распадаются на ионы: катионы и анионы. Растворы этих веществ проводят электрический ток. Электролитами являются кислоты, основания и соли. Процесс распада молекул электролитов на катионы и анионы называется электролитической диссоциацией.
Кислоты диссоциируют на ионы водорода Н+ и кислотный остаток. При этом число ступеней диссоциации зависит от основности кислоты.
Например, серная кислота диссоциирует в две ступени
H2SO4 = Н+ +HSО4-,
HSO4-= Н+ +SO42- или
H2SO4= 2H++SO42-
Соляная кислота - в одну ступень
HCl= Н+ +CI-.
Основания диссоциируют на гидроксид-ионы и ионы металла. Число ступеней диссоциации зависит от кислотности основания.
Например, гидроксид натрия диссоциирует в одну ступень
NaOH=Na++OH-
а гидроксид кальция - в две
Са(ОН)2=СаОН++ОН-
СаОН+= Са2++ОН- или
Са(ОН)2= Са2++2ОН-.
Соли диссоциируют на кислотный остаток и ионы металла
NaCl= Na++Cl-,
Na2SO4= 2Na++SO42-.
В зависимости от соотношения концентраций нераспавшихся молекул к концентрации ионов все электролиты делятся на' сильные, средние и слабые. Если молекулы веществ диссоциируют в растворах полностью, то они называются сильными электролитами. Если молекулы веществ диссоциируют в растворах не полностью, то они называются средними и слабыми электролитами. В растворах средних и слабых электролитов наряду с ионами существуют неионизированные молекулы.
Количественной характеристикой способности электролита распадаться на ионы является степень электролитической диссоциации α.
Она показывает, какая доля от общего количества электролита распадается на ионы.
Степень электролитической диссоциации равна отношению числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
Вещества, молекулы которых не распадаются на ионы, называются неэлектролитами.
К сильным электролитам относятся:
• кислоты: H2SO4, HNO3, HC1, НВг;
• растворимые основания (щелочи): NaOH, КОН, Ва(ОН)2;
• практически все растворимые соли.
Чем больше а, тем сильнее электролит. Для сильных электролитов α=1. Электролитическая диссоциация характеризуется также константой диссоциации К. Например, в водном растворе уксусной кислоты устанавливается равновесие
СНзСООН ↔Н++СН3СОО-.
Тогда
К=[Н+] [СН3СОО-]/[СНзСООН].
Константа и степень диссоциации связаны соотношением (закон разбавления Оствальда)
K=α2CM/(l-α),
где См - молярная концентрация электролита. Если степень диссоциации значительно меньше 1, то при приближенных вычислениях можно принять, что
1-α=1. Тогда выражение закона разбавления упрощается
К = α2См,
откуда
α=√К/См.
Это выражение показывает, что. при разбавлении раствора степень диссоциации возрастает.
Пример: Сколько ионов, катионов и анионов образуется в результате электролитической диссоциации 2 молекул FeCl3?
Решение: пишем уравнение электролитической диссоциации хлорида железа
FeCl3=Fe3++3Cl-.
Тогда при диссоциации двух молекул образуется
2FeCl3=2Fe3++2*3Cl-
8 ионов: 2 катиона и 6 анионов.
Свойства растворов электролитов, зависящие от концентрации (понижение температуры замерзания, повышение температуры кипения, осмотическое давление), не подчиняются закону Вант-Гоффа, так как при диссоциации частичная концентрация раствора возрастает. Для количественного описания данных свойств растворов электролитов Вант-Гдфф ввел в уравнения множитель i, названный изотоническим коэффициентом. Следовательно, для электролитов
Δtзам =i*K*m,
Δtкип =i*E*m,
P0CM=i*CMRT.
Изотонические коэффициенты находят путем сопоставления величин Δtзам, Δtкип, Росм., определяемых экспериментально, с соответствующими величинами, полученными расчетом. Для электролита данной концентрации
i= Δt ОПЫТ/ Δt р асч=ропьгг/р расч.
Изотонический коэффициент и степень диссоциации связаны между собой уравнением
i= 1 +α (k-1) или α= (i-1)/(k-1),
где k - число ионов, на которые распадается при диссоциации молекула электролита.
Пример: найти изотонический коэффициент хлорида магния MgCl2. Сильный электролит, α=1.
Решение: напишем уравнение электролитической диссоциации хлорида магния
MgCl2=Mg2++2Cl-.
То есть k=3.
Тогда
i=l+α(k-l)=l+l(3-l)=3.
ТЕМА 5.5 ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН) РАСТВОРОВ
Вода является слабым электролитом, диссоциирует в незначительной мере, образуя ионы водорода и гидроксид-ионы
Н2О↔Н++ОН-
Этому процессу соответствует константа диссоциации
К=[Н+][ОН-]/[Н2О].
Так как степень диссоциации воды очень мала, то равновесная концентрация недиссоциированных молекул воды [Н2О] с достаточной точностью равна общей концентрации воды, то есть 1000/18=55,55 моль/л. В разбавленных водных растворах концентрация воды мало изменяется, так что ее можно считать постоянной величиной. Тогда выражение для константы диссоциации воды можно преобразовать следующим образом:
[H+][0H-] = K[H20] = KHiO.
Константа KH20, равная произведению концентраций ионов Н+ и ОН-, представляет собой постоянную при данной температуре величину и называется ионным произведением воды.
В чистой воде концентрации ионов водорода и гидроксид-ионов одинаковы и при 25°С составляют 10"7 моль/л. Отсюда следует, что при этой температуре
KHiO=10-14
Сростом температуры диссоциация воды увеличивается, так как это процесс эндотермический.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами
[Н+]=[ОН-]=10 -7моль/л.
В кислых растворах [Н+]>[ОН-], в щелочных растворах [Н+]<[ОН-]. Вместо концентрации удобнее пользоваться их десятичными логарифмами, взятыми с обратным знаком; эти величины обозначаются символами рН и рОН и называются соответственно водородным и гидроксильным показателями
рН=-lg[Н+]
pOH=-lg[OH-].
Логарифмируя соотношение [H+][OH-]=KH2Oи меняя знак на обратный, получим
pH + pOH = pKH2O.
В частности, при 25°С рН+рОН=14. При этой температуре в нейтральных растворах рН=7, в кислых рН<7, в щелочных - рН>7.
Пример: Чему равна величина рН раствора, если концентрация ионов водорода в растворе равна 10 -8 моль/л? Решение: рН= -lg[H+]= -lg 10 -8=8.
ТЕМА 5.6 ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком электролита и ионами электролита в растворе.
Например, в насыщенном растворе сульфата бария устанавливается следующее равновесие
BaSO4↔Ba2++SO42-.
Выражение для константы равновесия данного процесса выглядит следующим образом
K=[Ba2+][SO42-]/[BaSO4].
Знаменатель, этой дроби есть величина постоянная, поэтому произведение
К[ BaSO4]= const.;
Отсюда следует, что произведение
[Ba2+][SO42-] = const, называется произведением растворимости и обозначается ПР. То есть
ПP=[Ba2+][SO42-].
Отсюда следует что, произведение концентраций ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости), есть величина постоянная при данной температуре.
Если молекула электролита при диссоциации образует два или несколько одинаковых ионов, то в выражении для произведения растворимости концентрации этих ионов должны быть возведены в соответствующие степени, например
ПP(CaF2 )=[Ca2+][F-]2
ПР(Са3 (PO4)2)=[Ca2+]3[PO43-]2.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением •растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР. Наоборот, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР.
Пример: растворимость Mg(OH)2 при 18°С равна 1,7*10 -4 моль/л. Найти ПР Mg(OH)2 при этой температуре.
Решение: при растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионовМg2+ и вдвое больше ионов ОН-. Следовательно, в насыщенном растворе Mg(OH)2
[Mg2+]=1,7*10 -4 моль/л;
[ОН-]=3,4*10 -4моль/. Отсюда
ПP=[Mg2+][OH-]2=l,7*10-4*(3,4*.10 -4)2=l,96*10 -11.
ТЕМА 5.7 ГИДРОЛИЗ СОЛЕЙ
 2015-05-14
2015-05-14 1085
1085








