Для оценки термодинамического равновесия применяются диаграммы Eh-pH (φ-рН), которые наглядно изображают области устойчивости и границы сосуществования разнообразных форм и соединений для конкретной системы (например, Me-H2О, MeS-H2O, Me-NH3-H2O и др.) в зависимости от величин окислительно-восстановительного потенциала и рН среды при фиксированных температуре и активности ионов. Принципы их построения были разработаны применительно к анализу наиболее простых систем типа Me-H2O, характерных для процессов коррозии металлов (диаграммы Пурбэ). Позднее этот принцип термодинамического анализа был распространен для анализа геохимических процессов; а в 70-80-е годы успешно применялся при анализе равновесных состояний систем, характерных для гидрометаллургии тяжелых цветных металлов.
Для взаимодействия, описываемого схемой
aA + eB + mH+ = сС + dD,
уравнение обратимого электродного потенциала записывается в следующем виде:
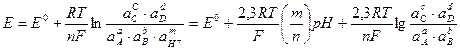
где а - активность ионов-участников реакции (напомним, что для твердого вещества а =1,0; для ионов - произведению его молярной концентрации на величину коэффициента активности).
Задаются величиной активностей ионов-участников взаимодействия и строят прямую линию, исходящую из ординаты Е 0при рН=0 с наклоном, равным 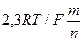 (при 298 К угловой коэффициент (2.3RT/F) равен 0,059
(при 298 К угловой коэффициент (2.3RT/F) равен 0,059 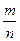 ).
).
При m =0 получают горизонтальную линию, а при n=0 - вертикальную, при этом используют уравнение
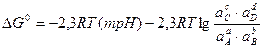 .
.
Начальное значение рН, соответствующее вертикальной линии, определяют по уравнению

При n, не равном 0, значение стандартного электродного потенциала и изменения свободной энергии Гиббса связаны соотношением 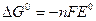 .
.
Влияние повышения давления практически не сказывается на виде диаграмм Eh-pH, поскольку для используемых интервалов давлений изменение коэффициентов фугативности крайне незначительно.
При температуре, отличающейся от стандартной, линии на диаграммах Eh-pH смещаются относительно оси ординат, поскольку величины и 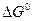 , и Е° зависят от температуры. Однако это трудно учитываемо, т.к. термодинамических характеристик ионов в зависимости от температуры недостаточно.
, и Е° зависят от температуры. Однако это трудно учитываемо, т.к. термодинамических характеристик ионов в зависимости от температуры недостаточно.
При условии, что величины 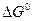 и
и 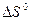 постоянные и не зависят от температуры, используют следующее уравнение для нахождения величин
постоянные и не зависят от температуры, используют следующее уравнение для нахождения величин 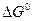 и F 0 (при 298 К):
и F 0 (при 298 К):
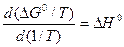 ;
; 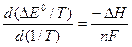
При повышенных температурах используют уравнения
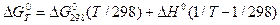
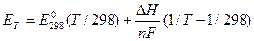 .
.
Форма и размеры областей существования отдельных соединений с увеличением температуры изменяются, однако, общие закономерности, выявленные расчетным путем для стандартных условий, сохраняются.
Активности ионов учитывают в пределах 10-1-10-8; при концентрациях более 10-1 заметны расхождения между активностью и моляльностью; при концентрациях менее 10-8 значение моляльности теряет смысл, а системы практически не интересны для гидрометаллургии. При наличии в растворе нескольких типов ионов систему рассматривают при условии, что их активности равны между собой, и рассчитывают равновесное рН сосуществования этих ионов.
Процессы описываются на диаграмме линиями:
- параллельными оси абсцисс (ионы Н+ или ОН- не участвуют);
- параллельными оси ординат (ОВ - реакции отсутствуют);
- с углом наклона а (180°>α>0) - для ОВ реакций с участием ионов Н+ или ОН-.
Поля устойчивости ограничиваются линиями с одинаковыми значениями активности ионов. Границы между полями устойчивости изображаются линиями: контурными - для твердых фаз, тонкими - для твердых фаз и ионов, пунктирными - для ионов. Нижняя граница области термодинамической устойчивости воды (I) соответствует зависимости равновесного потенциала водорода от рН; верхняя граница этой области (II) соответствует зависимости равновесного потенциала кислорода от рН.
Диаграмма Eh-pH дает ответ на вопрос: при каких значениях Eh и рН конкретные фазы А и Б находятся в растворе, но это не распространяется на соотношения во всей системе, где могут быть и другие формы, в которые способны переходить соединения А и Б, например МnО→МnО2→Мn2О72- и т.д. Необходимо учесть, что:
- незнание коэффициентов активности вызывает ошибки при вычислении равновесной растворимости;
- если твердое вещество находится в равновесии с раствором, то сумма активностей всех растворенных компонентов, содержащих данный элемент, всегда меньше концентрации этого же элемента, определяемой аналитически, поэтому приходится в первом приближении ориентироваться на минимальную растворимость.
Основными источниками ошибок при построении диаграмм Eh-pH являются:
1) использование недостоверных величин изменения свободной энергии Гиббса (не учитывается эффект полиморфных модификаций, неточности экспериментальных определений или методик расчетов);
2) использование при анализе равновесий фаз, для которых величины 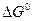 мало отличаются друг от друга;
мало отличаются друг от друга;
3) химический состав и структура минералов, особенно с переменным составом или кристаллогидратов, отличается от аналогичных свойств для чистых препаратов;
4) не учитывается роль температуры и давления (как правило, их рассчитывают для стандартных условий (298 К и Р=0,1 МПа)); из-за относительно умеренных температур (до 600 К) и давлений (до 5,0 МПа), используемых в автоклавной гидрометаллургии, возникающие неточности сопоставимы с общей погрешностью расчетов.
Используются математические программы для расчета диаграмм Eh-pH.
Термодинамический анализ с использованием диаграмм «потенциал-pH» (диаграмм Пурбэ)
Диаграммы j-pH для воды. Вода может разлагаться с выделением водорода и кислорода.
Равновесие восстановления воды можно выразить полуреакцией:
Н2(газ) Û 2Н+(раств) + 2е.
Для этой реакции при Т = 298 К:
j = jоН2/Н+ + (0,059/2) lg (а2Н+/РН2) или
j = jоН2/Н+ + 0,059 lg аН+ - 0,0295 lg РН2.
Поскольку jоН2/Н+ = 0, то при РН2 = 1 атм.
j = -0,059 рН (рисунок 2 линия aa)..
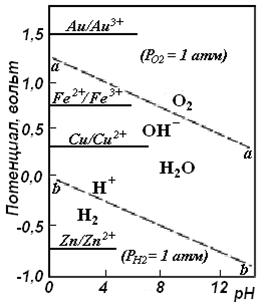
Рисунок 12.1 -
Зависимость j – рН можно графически представить на диаграмме прямой линий cd с тангенсом угла наклона 0,059 (рисунок 12.1).
Для реакции окисления воды:
2Н2О Û О2(газ) + 4Н+(раств) + 4е,
j = jоН2О/О2 + (0,059/4) lg (а4Н+/РО2) или
j = jоН2О/О2 + (0,059/4) lg а4Н+ + (0,059/4) lg РО2.
Поскольку jоН2О/О2 = 1,23 в, то при РО2 = 1 атм.,
j = 1,23 – 0,059 рН. В пределах рН от 0 до 14 потенциал изменяется от 1,23 до 0,401 в (рисунок 2 линия bb).
Таким образом, область устойчивого существования воды ограничена линиями ab. При давлениях водорода и кислорода, отличных от 1 атм., линии на диаграмме сместятся вверх или вниз. Из уравнений для потенциалов видно, что если РН2 > 1 атм., то водородный потенциал будет более отрицательным. При РО2 > 1 атм. кислородный потенциал станет более положительным. Область устойчивости воды, таким образом, расширяется.
При РН2 и РО2 меньше 1 атм., область стабильного существования воды наоборот сужается.
На диаграммах j-pH для любых систем всегда пунктиром наносятся линии, ограничивающие область устойчивости воды.
 2015-05-12
2015-05-12 1898
1898








