Современные представления о природе химической связи сложились после создания квантовой механики. Согласно квантово-механическим представлениям электроны в атомах находятся на атомных орбиталях. Под атомной орбиталью подразумевается область пространства вокруг атомного ядра, где наиболее высокая вероятность нахождения электрона.
1. Главное квантовое число «n», которое определяет энергию и размер АО и принимает положительные целочисленные значения. Эти значения соответствуют номеру периода в таблице Менделеева.

2. Орбитальное квантовое число (побочное или азимутальное) «l» характеризует форму орбитали и принимает значения от 0 до n-1 (l = 0, 1, 2, …. n-1). АО для l=0 имеет форму сферы и называется s – орбиталью. АО для l = 1 имеет форму гантели и называется p–орбиталью. АО для l = 2 имеет форму лепестков и называется d-орбиталью:
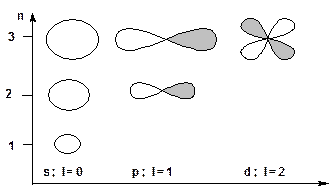
3. Магнитное квантовое число «m». Характеризует пространственную ориентацию и принимает значения 0, ±1, ±2, ….±l
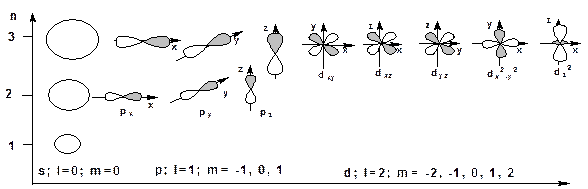
 2015-05-12
2015-05-12 556
556








