По способности растворять в себе компоненты соединения. Область твердых растворов компонентов на основе соединения называют областью гомогенности соединения.
Различают соединения с широкой (исчисляемой процентами) и с узкой (десятыми и меньшими долями процента) областью гомогенности. Узкие области гомогенности, как правило, не удается показать на диаграммах фазового равновесия, построенных в обычном масштабе, однако они приводятся на неполных фазовых диаграммах, представляющих «вырезки» из полных. Области гомогенности в таких вырезках из фазовых диаграмм очерчены линиями солидуса и растворимости.
Соединения, образующие широкие области гомогенности. Соединения этого типа весьма распространены в металлических и некоторых полупроводниковых системах. Н. С. Курнаков выделил среди подобных соединений двегруппы: дальтониды и бертоллиды.
Далътониды — соединения с широкой областью гомогенности — характеризуются тем, что соединение формульного состава находится внутри области гомогенности (рис.10.13, а —в); общим для диаграмм с дальтонидными фазами является присутствие сингулярной точки на кривых ликвидуса и солидуса, состав в которой отвечает дальтониду и простым стехиометрическим соотношениям компонентов. На диаграмме состав—свойство формульному составу соединения, как правило, соответствует экстремальное значение ряда свойств.
|
|
|
Бертоллиды характеризуются тем, что соединение формульного состава лежит вне области гомогенности (рис. 10.13, г и д). Это означает, что соединение бертоллидного типа формульного состава не существует. Сплав, отвечающий формуле соединения, состоит из двух фаз, одна из которых представляет собой твердый раствор на основе соединения. Изобарно-изотермный потенциал этого твердого раствора меньше изобарно-изотермного потенциала соединения строго формульного состава. На диаграмме состав—свойство в пределах составов, отвечающих области гомогенности, свойства изменяются монотонно.
Соединения, образующие узкие области гомогенности. К ним относится большинство полупроводниковых соединений, которые образуют узкие области твердых растворов с компонентами, входящими в состав соединений. Так, ширина области гомогенности колеблется от десятых (например, в соединениях типа А211В3 VI, в частности для In2Те3 — от 59,5 до 60,0 % (ат.) Те) до сотых (А11ВШ) и даже тысячных (АШВV) долей атомного процента. Подчеркнем, однако, что соединения с узкими областями гомогенности в многокомпонентных системах (К > 2) могут образовывать на своей основе твердые растворы большой протяженности.
|
|
|
Несмотря на малую величину, растворимость играет важнейшую роль в формировании физических свойств соединения. Поэтому изучение свойств твердых растворов, расположенных в узкой области гомогенности (т. е. с избытком компонентов А и В), представляет собой важную и экспериментально сложную задачу.
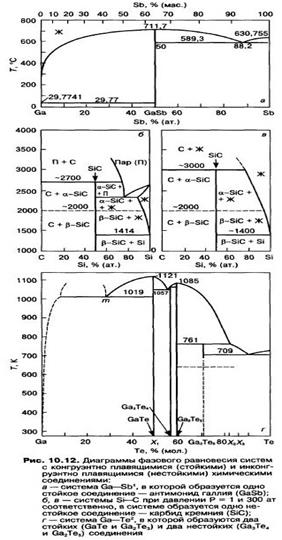
15) Диаграммы состояния систем с конгруэнтно плавящимися промежуточными фазами
Соединения этого типа образуются во многих системах типа полупроводник—полупроводник, металл—полупроводник, металл—металл.
Промежуточные фазы, при плавлении которых составы жидкой и твердой фаз совпадают, называют конгруэнтно плавящимися (от лат. congruens— совпадающий, соответствующий).
Если промежуточная фаза имеет постоянный состав, т.е. представляет собой определенное соединение АтВn а граничные растворы на основе компонентов А и В - узкие области гомогенности, которыми можно пренебречь (рис. 20, а), то ликвидус диаграммы состояния изображают тремя кривыми A'е'1, В'е'2 и е'1 m' е'2начала кристаллизации практически чистых компонентов A, В и соединения АтВn, а солидус -двумя эвтектическими горизонталями ab и cd при температурах te1 и te2 Соединение АтВn кристаллизуется (или плавится) при постоянной температуре t m, отвечающей точке максимума т' на кривой ликвидуса е'1 m' е'2.Обычно такие диаграммы состояния характерны для систем, образованных металлами с полуметаллами, когда промежуточная фаза представляет собой соединение с нормальной валентностью или полупроводниковую фазу.
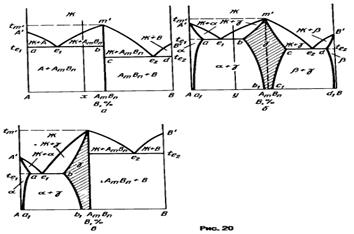
Для диаграммы состояния с конгруэнтно плавящейся промежуточной  -фазой переменного состава (рис. 20, б) характерны сравнительно широкие области граничных а- и b-растворов и заметная растворимость компонентов А и В в соединении АтВn, лежащем в основе у-фазы. В результате промежуточная
-фазой переменного состава (рис. 20, б) характерны сравнительно широкие области граничных а- и b-растворов и заметная растворимость компонентов А и В в соединении АтВn, лежащем в основе у-фазы. В результате промежуточная  -фаза имеет свою область гомогенности b1 bm'cc 1(на рис. 20, б эта область заштрихована).
-фаза имеет свою область гомогенности b1 bm'cc 1(на рис. 20, б эта область заштрихована).
16) Промежуточные фазы, при плавлении которых состав жидкой фазы отличается от состава твердой фазы, называют инконгруэнтно плавящимися (от лат. incongruens — несовпадающий, несоответствующий). При плавлении таких фаз помимо жидкости образуется новая твердая фаза, состав которой также отличается от состава плавящейся фазы. Иначе говоря, плавление инконгруэнтно плавящейся фазы происходит по реакции, обратной перитектической.
Если инконгруэнтно плавящаяся промежуточная фаза имеет постоянный состав, т.е. выступает как соединение AmBn и взаимная растворимость компонентов А и В в твердом состоянии незначительна (рис. 24, а), то перитектическую реакцию, по которой она образуется, можно записать как Жр + В=AmBn, а плавление - как AmBn — »Жр + В.
Ликвидус этой диаграммы состояния изображается тремя кривыми А'е, В'р и ер начала кристаллизации компонентов A, B и соединения AmBn. Солидусом сплавов, расположенных на участке А - АтВп, служит эвтектическая горизонталь ас при температуре tB, а сплавов участка АтВп - В - часть sb перитектической горизонтали pb при температуре tp.
Если инконгруэнтно плавящаяся промежуточная 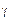 -фаза имеет переменный состав и на основе компонентов А и В образуются граничные
-фаза имеет переменный состав и на основе компонентов А и В образуются граничные 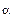 - и
- и 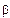 -растворы, то характер диаграммы состояния такой
-растворы, то характер диаграммы состояния такой
системы принципиально не изменится, лишь несколько усложнится линия солидуса (рис. 24, б). Температуры начала кристаллизации граничных а- и 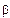 -растворов и промежуточной
-растворов и промежуточной 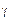 -фазы изображаются кривыми А'е, В'р и ер, а температуры конца кристаллизации - соответственно кривыми А'а, В'b и sc.
-фазы изображаются кривыми А'е, В'р и ер, а температуры конца кристаллизации - соответственно кривыми А'а, В'b и sc.
Инконгруэнтно плавящиеся промежуточные фазы называют также фазами со скрытым максимумом, подчеркивая, что на их кривых ликвидуса и солидуса нет точки максимума (дистектической точки). Скрытый максимум m' этих фаз можно показать пунктиром рm' в двухфазной области Ж + В (см. рис. 24, а) или рт' и m's в области Ж + 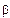 (см.рис. 24, 6). В первом случае кривая рт' изображает состав жидкости, находящейся в равновесии Ж = АтВn а во втором кривые рт' и sm' — состав жидкости, находящейся в равновесии Ж =
(см.рис. 24, 6). В первом случае кривая рт' изображает состав жидкости, находящейся в равновесии Ж = АтВn а во втором кривые рт' и sm' — состав жидкости, находящейся в равновесии Ж = 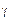 . Оба равновесия метастабильны и если бы реализовались, то должны были бы замениться стабильными равновесиями Ж = В и Ж = р.
. Оба равновесия метастабильны и если бы реализовались, то должны были бы замениться стабильными равновесиями Ж = В и Ж = р.
|
|
|
Из диаграммы состояния (см. рис. 24, а) видно, что скрытый максимум т' отвечает составу соединения АтВn Если промежуточная у-фаза имеет переменный состав (см. рис. 24, б), то этот максимум может оказаться за пределами области гомогенности у-фазы. Кроме того, состав соединения АтВn не отвечает точке s на перитектической горизонтали pb, хотя эта точка изображает состав промежуточной 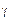 s-фазы, образующейся по перитектической реакции Жр+ Bb ►
s-фазы, образующейся по перитектической реакции Жр+ Bb ► 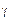 s
s
Скрытый максимум - это условное построение, редко применяемое при анализе фазовых равновесий, поскольку метастабильные равновесия Ж =АтВn (см. рис. 24, а) или Ж = 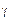 (см. рис. 24, б) не реализуются при перегреве сплавов выше температуры перитектической горизонтали pb
(см. рис. 24, б) не реализуются при перегреве сплавов выше температуры перитектической горизонтали pb
Инконгруэнтно плавящееся соединение АтВn (см. рис. 24, а) можно рассматривать как компонент при температурах ниже tр перитектической горизонтали pb, а систему А - В - делить на более простые части А - АтВn и АтВn - В, независимые одна от другой в интервале температур tp - tK0MH существования соединения АтВn
17) Обычно для изображения составов тройных сплавов используют плоскость, ограниченную сторонами правильного (т.е. равностороннего) треугольника. В вершины такого концентрационного треугольника (рис. 51) помещают компоненты А, В и С, стороны АВ, ВС и АС служат для изображения составов двойных сплавов, а на плоскости изображают составы тройных сплавов. В обоих случаях концентрации компонентов в сплавах обычно выражают в процентах (по массе или атомных) или долях (атомных или мольных) от единицы.
Пусть точка М - фигуративная точка тройного сплава. Если через эту точку провести три прямые а1а2, b 1b2 и c1c2 (рис. 51) параллельно сторонам треугольника, то сумма трех отрезков С а1 Ab1 и Вс1 (или Ва2, Сb2 и Ас2), отсекаемых этими прямыми на сторонах треугольника, есть величина постоянная, равная стороне треугольника, например АВ, т.е.
|
|
|
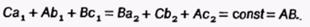
Если сторону концентрационного треугольника принять равной единице или 100 %, то с помощью отрезков Са1 Аb1 и Вс1 (или Ва2, Сb2 и Ас2) можно определить концентрацию каждого из компонентов в сплаве М
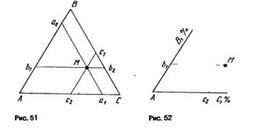
Так как фигуративная точка этого сплава лежит около стороны ВС (двойной системы В - С), то, очевидно, концентрации компонентов В и С превышают концентрацию компонента А. Значит, кон-цент'рацию компонента А можно определить с помощью небольших отрезков Са1 или Ва2, которые от вершин компонентов С и В как бы "откладываются" в сторону компонента А.
Также видно, что концентрация компонента С в сплаве М превышает концентрацию компонента В (фигуративная точка сплава находится ближе к вершине компонента С). Следовательно, концентрацию компонента С в сплаве М можно определить самыми большими отрезками B с1 или Ас2, которые опять от вершин компонентов В и А "откладываются" в сторону компонента С. Наконец, концентрацию компонента В можно определить отрезками Аb1 или Сb2, которые от вершин компонентов А и С "откладываются" в сторону компонента В.
Следует отметить, что первые три отрезка Ca 1, Bb 1 и Ас1 "откладываются" от вершин концентрационного треугольника в направлении, совпадающем с ходом часовой стрелки, а другие отрезки Ва2, Сb2 и Ас2- в обратном направлении.
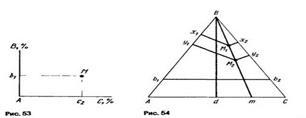
При отыскании фигуративной точки тройного сплава на плоскости концентрационного треугольника по его заданному химическому составу поступают следующим образом (рис. 52). От одной из вершин треугольника, например вершины компонента А, принятого за основу сплава, по сторонам АВ и АС откладывают отрезки Ab1 и Ас2, измеряющие концентрации компонентов В и С. Затем через точки b1 и с2 параллельно сторонам АВ и АС проводят прямые b1М и С2М, которые пересекутся в фигуративной точке искомого сплава М.
Из рассмотренного свойства концентрационного треугольника (см. рис. 51) вытекает ряд особенностей состава разных групп тройных сплавов:
1. Все сплавы прямой, параллельной одной из сторон концентрационного треугольника, содержат постоянное количество того компонента, который находится в вершине треугольника против этой порямой.
2. Все сплавы прямой, проходящей через одну из вершин концентраццоного треугольника, содержат в постоянном отношении те компоненты, которые располагаются по обе стороны от этой прямой.
3. Все сплавы, лежащие на высоте концентрационного треугольника, характеризуются одинаковым содержанием тех компонентов, которые располагаются по обе стороны от этой высоты.
Для изображения фазовых равновесий в тройной системе А - В - С при разных температурах к плоскости концентрационного треугольника восстанавливают перпендикулярную ось, вдоль которой откладывают значения температуры (рис. 55). Такая пространственная диаграмма состояния позволяет изображать фазовые равновесия в любом тройном сплаве и во всей системе А - В — С в целом при разных температурах (естественно, при постоянном давлении). На плоскости концентрационного треугольника отсчитывают концентрации компонентов не только в сплавах, но и в различных фазах, которые существуют в этих сплавах.
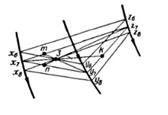
Проследить за изменениями долей различных фаз в сплаве 3 при кристаллизации эвтектики 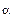 +
+ 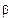 можно с помощью правила центра тяжести треугольника, которое является дальнейшим развитием правила рычага применительно к трехфазным сплавам. Наряду с треугольниками x6y6z6 и x8y8z8 изображающими равновесие фаз в моменты начала и конца кристаллизации эвтектики
можно с помощью правила центра тяжести треугольника, которое является дальнейшим развитием правила рычага применительно к трехфазным сплавам. Наряду с треугольниками x6y6z6 и x8y8z8 изображающими равновесие фаз в моменты начала и конца кристаллизации эвтектики 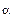 +
+ 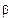 , на рис. 72 показан еще один треугольник x7y7z7 который изображает эвтектическое равновесие ЖУ7 =
, на рис. 72 показан еще один треугольник x7y7z7 который изображает эвтектическое равновесие ЖУ7 = 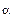 X7 +
X7 + 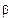 Z7 при некоторой промежуточной температуре tу7 в интервале кристаллизации эвтектики
Z7 при некоторой промежуточной температуре tу7 в интервале кристаллизации эвтектики 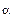 +
+ 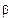 , когда в сплаве 3 присутствуют все три фазы: ЖУ7,
, когда в сплаве 3 присутствуют все три фазы: ЖУ7, 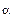 х7 и
х7 и 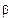 Z7. Если через вершины этого треугольника и фигуративную точку сплава провести три отрезка до пересечения с противоположными сторонами, то с помощью отношений отрезков 3m/my7, 3k/kx7 и 3n/nz7 можно определить доли жидкости Жy7,
Z7. Если через вершины этого треугольника и фигуративную точку сплава провести три отрезка до пересечения с противоположными сторонами, то с помощью отношений отрезков 3m/my7, 3k/kx7 и 3n/nz7 можно определить доли жидкости Жy7, 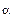 х7-
х7- 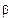 Z7 -кристаллов в этом сплаве.
Z7 -кристаллов в этом сплаве.
По существу, фигуративная точка сплава 3 является центром тяжести масс его фаз, а записанные отношения отрезков - условием механического равновесия плоского рычага в виде треугольника x7y7z7, к вершинам которого "подвешены" эти фазы.
 |
18) Условия, которым должны удовлетворять исходные компоненты для того, чтобы в тройной системе могла реализоваться неограниченная растворимость: однотипность химических связей, изоморфность кристаллических решеток, близость размеров атомных радиусов, небольшое различие в электроотрицательности компонентов.
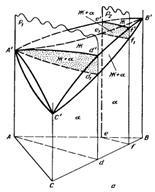
На рис. 11.3, а схематически показана тройная диаграмма с неограниченной растворимостью. Каждая такая диаграмма слагается из трех двойных диаграмм с неограниченной растворимостью компонентов. А'l'"В'l'С'l"А' — поверхность ликвидуса, которая представляет собой геометрическое место фигуративных точек жидких растворов предельной концентрации; А'S'"В'S'С'S"А' — поверхность солидуса — геометрическое место фигуративных точек твердых растворов предельной концентрации.
В качестве примера рассмотрим кристаллизацию сплава I (см. рис. 11.3), которая начинается при температуре Тн в точке SН и заканчивается при температуре Тк в точке SК на поверхности солидуса. Состав жидкой фазы меняется в ходе кристаллизации по кривой Lн —Lпр—Lк на поверхности ликвидуса, а состав твердого раствора — по кривой SН—SПр—SК на поверхности солидуса. Точки Lпр и Sпр соответствуют составам жидкого и твердого растворов при некоторой промежуточной температуре.
Следует заметить, что кривые Lн —Lпр— Ьк и SН—Sпр—SК (каждая в отдельности и тем более вместе) не лежат в одной вертикальной плоскости. Это видно и по их проекциям L'я— L'пр— L'к и S`Н—S`пр—S`К на плоскость концентрационного треугольника на рис. 11.3.
Конода, соединяющая фигуративные точки жидкой и твердой фаз, находящихся в равновесии при каждой данной температуре, сохраняя в ходе кристаллизации горизонтальное положение, вращается с понижением температуры от Тн до Тк вокруг вертикальной оси I—I`; при этом одним концом она скользит по поверхности ликвидуса по кривой Lя — Ьпр — Ьк, а другим — по поверхности солидуса по кривой SН—5пр—5К.
Проекции положений конод при Тн, Тпр, Тк изображаются проекциями L'я — S'И, Lр—S`пр, L'к — S'к соответственно. Видно, что в разные моменты кристаллизации коноды лежат в разных вертикальных плоскостях.
Изотермические разрезы. На рис. 58показаны тройная диаграмма с неограниченной растворимостью.
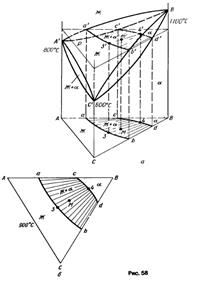
Таким образом, изотермические разрезы характеризуют фазовые равновесия при температуре разреза.
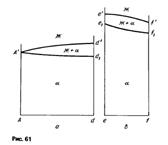
Политермические разрезы. На рис. 60 представлены следы сечения тройной диаграммы двумя вертикальными плоскостями, а на рис. 61
19) Тройная диаграмма фазовых равновесий системы с моновариантным (трехфазным) эвтектическим превращением
Тройная диаграмма, в которой реализуется моновариантное трехфазное эвтектическое превращение, образована двойными диаграммами: одна с неограниченной растворимостью компонентов друг в друге в твердом и жидком состояниях и две с эвтектическим разрывом растворимости.
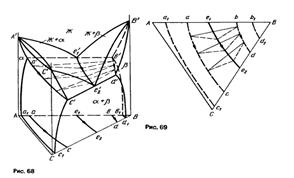
Тройная система А - В - С с моновариантным эвтектическим равновесием Ж = 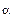 +
+ 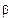 (рис. 68) образована двумя двойными системами А - В и В - С эвтектического типа и системой А - С с непрерывными рядами жидких и твердых
(рис. 68) образована двумя двойными системами А - В и В - С эвтектического типа и системой А - С с непрерывными рядами жидких и твердых 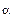 -растворов. Граничный раствор на основе компонента В обозначен как
-растворов. Граничный раствор на основе компонента В обозначен как 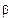
На рисунках 68 и 69 приведена сама диаграммы и и проекция на плоскость соответственно.
 |
Фазовые превращения приведены на рисунках 70 и 71
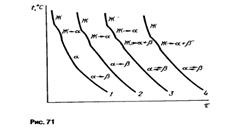 |
Изотермическое сечение. На изотермическом сечении (см. рис. 73)
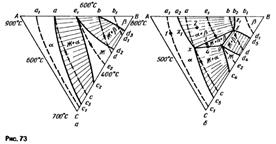 |
Политермическое сечение. Рассмотрим характерный политермический разрез тройной диаграммы. Смотри рис. 74.
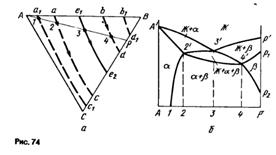 |
 2015-05-13
2015-05-13 1851
1851







