В газе, находящемся в состоянии равновесия, установится некоторое стационарное (не меняющееся со временем) распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Такой закон был теоретически выведен Максвеллом в 1859 г. и был опубликован в 1860 г.
При выводе этого закона Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Предполагалось также, что внешние поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f (v), называемой функцией распределения молекул по скоростям. Различают три формы записи распределения Максвелла. Мы изучим одну из них.
1.6.1. Распределение Максвелла по модулю скорости молекул
Обозначим через dN v число молекул, скорости которых лежат в интервале от v до v+dv, тогда dN v/ N – характеризует относительное число этих молекул. Принято вводить функцию распределения молекул по скоростям
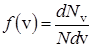 . (24)
. (24)
Максвелл показал, что эта функция имеет вид
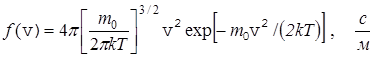 . (25)
. (25)
Функция 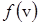 характеризует плотность вероятности того, что скорость молекулы равна v, и поэтому эта функция удовлетворяет условию нормировки
характеризует плотность вероятности того, что скорость молекулы равна v, и поэтому эта функция удовлетворяет условию нормировки
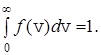 (26)
(26)
|
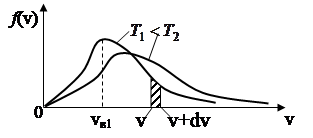 Используя функцию распределения, можно найти относительное число молекул DN/N, скорости которых лежат в интервале от v1 до v2
Используя функцию распределения, можно найти относительное число молекул DN/N, скорости которых лежат в интервале от v1 до v2
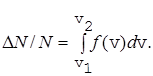 (27)
(27)
Анализ (24) показывает, что вид функции зависит от массы молекулы m0 и от температуры Т.
На рис.4 представлен вид функции f (v) для двух температур. Характерно, что f (v), начинаясь от нуля, достигает максимума при vВ и затем асимптотически стремится к нулю.
Относительное число молекул dN V/ N, скорости которых лежат в интервале от v до v+dv находится как площадь dS заштрихованной полоски на рис. 4. Площади, ограниченные кривыми, согласно (26), одинаковы и равны единице.
Скорость, при которой функция распределения молекул по скоростям максимальна, называется наиболее вероятной скоростью vB. Исследование (24) на максимум позволило найти наиболее вероятную скорость молекул
vB= 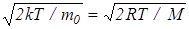 . (28)
. (28)
Из формулы (28) следует, что при повышении температуры максимум f (v) сместится вправо, в сторону больших скоростей.
Кроме наиболее вероятной и средней квадратичной скорости молекул газа, которые определяются по формулам (28) и (18), используется также средняя скорость молекул <v> или средняя арифметическая скорость. Она определяется по формуле
<v>= 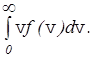 (29)
(29)
Подставляя f (v) [cм.(24)] и интегрируя, получим
<v>= 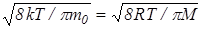 . (30)
. (30)
Итак существуют три формулы для определения скорости молекул газа: (18), (28), (30). Согласно этим формулам
vB::<v>:<vKB>= 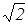 :
: 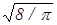 :
: 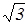 = 1: 1,13: 1,22. (31)
= 1: 1,13: 1,22. (31)
Таким образом, средняя и средняя квадратичная скорости превышают наиболее вероятную скорость на 13 и 22 % соответственно, т.е. отличие не очень большое.
Исходя из распределения молекул по скоростям (24), можно найти распределение молекул газа по кинетическим энергиям поступательного движения молекул Wк=m 0v 2 / 2. Это распределение характеризуется функцией f(Wк), которая вводится аналогично f (v)
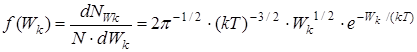 , 1/Дж (32)
, 1/Дж (32)
 2015-05-13
2015-05-13 1172
1172