Величины 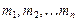 называют порядком реакции по веществу
называют порядком реакции по веществу 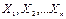 . Их сумму называют суммарным порядком реакции. Порядок реакции является одной из важнейших характеристик механизма протекания химической реакции. При этом величины
. Их сумму называют суммарным порядком реакции. Порядок реакции является одной из важнейших характеристик механизма протекания химической реакции. При этом величины 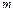 могут принимать целочисленные и дробные значения, а могут быть равны 0. Величины
могут принимать целочисленные и дробные значения, а могут быть равны 0. Величины 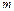 всегда неотрицательны. Для простых реакций (т.е. для реакций, протекающих без промежуточных соединений) величина
всегда неотрицательны. Для простых реакций (т.е. для реакций, протекающих без промежуточных соединений) величина 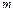 никогда не превышает трех.
никогда не превышает трех.
Величина 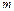 отображает механизм протекания химической реакции, в отличие от стехиометрических коэффициентов, отражающих пропорции между реагирующими веществами. Поэтому порядок реакции обычно не равен сумме стехиометрических коэффициентов, отражающих пропорции между реагирующими веществами.
отображает механизм протекания химической реакции, в отличие от стехиометрических коэффициентов, отражающих пропорции между реагирующими веществами. Поэтому порядок реакции обычно не равен сумме стехиометрических коэффициентов, отражающих пропорции между реагирующими веществами.
Для простых реакций порядок отражает число активных ударений между молекулами, вступающими в химическую реакцию. Исходя из пространственных соображений, очевидно, что вероятность столкновения более чем трех молекул одновременно близка к нулю. Поэтому элементарные реакции с порядком выше третьего не описаны. Порядок элементарной реакции всегда целочисленный; порядок сложной реакции (содержащей промежуточные соединения) может быть целым и дробным.
|
|
|
Простые реакции первого порядка являются мономолекулярными, т.е. протекающими вследствие превращений одной молекулы. Простые реакции второго порядка являются бимолекулярными. Они протекают вследствие взаимодействия двух молекул, и т.д.
Исторически Я. Вант-Гоффом (1884) понятия моно-, би- и тримолекулярных реакций было введено формально-математически как реакций, скорость которых описывается уравнением 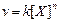 , где n - 1,2,3. Исходя из современных представлений, утверждение Вант-Гоффа верно лишь для простых реакций. Если же сложные реакции подчиняются уравнению Вант-Гоффа, то говорят о реакциях псевдопервого, псевдовторого или псевдотретьего порядков.
, где n - 1,2,3. Исходя из современных представлений, утверждение Вант-Гоффа верно лишь для простых реакций. Если же сложные реакции подчиняются уравнению Вант-Гоффа, то говорят о реакциях псевдопервого, псевдовторого или псевдотретьего порядков.
На определяемый из кинетического эксперимента порядок реакции может оказывать влияние соотношение концентраций реагирующих веществ. К примеру, порядок простой бимолекулярной реакции, протекающей в условиях избытка одного из реагирующих веществ, ошибочно может быть определен как первый.
 2015-05-13
2015-05-13 521
521








