Произведением растворимости вещества называется произведение концентраций ионов, которые образуются в результате реакции диссоциации вещества в соответствующих степенях в насыщенном растворе. Например: реакция диссоциации доломита CaMg(CO3)2 = Ca2+ +Mg2+ + 2CO32−; ПР(CaMg(CO3)2) = [Ca2+]×[Mg2+]×[CO32−]2. Т.к. понятия ПР вещества и константы равновесия реакции диссоциации (К) вещества совпадают, т.е. ПР = К, вычислить ПР можно по уравнению Вант – Гоффа: 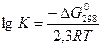 . ΔGо298 – стандартный изобарный потенциал реакции, R = 8,31441(Дж/(моль×оК) – газовая постоянная, [T] = температура раствора в градусах Кельвина.
. ΔGо298 – стандартный изобарный потенциал реакции, R = 8,31441(Дж/(моль×оК) – газовая постоянная, [T] = температура раствора в градусах Кельвина.
Задача. Вычислить массу карбоната бария (BaCO3), содержащегося
в 10 л насыщенного раствора. ПР(BaCO3) = 4×10–10
Решение: реакция диссоциации BaCO3 = Ba2+ + CO32–, [Ba2+] = [CO32–] следовательно 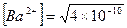 = 2×10–5 (моль /л), т.е. в 1 л раствора содержится 2×10–5 моля иона Ва2+. Из уравнения диссоциации барита следует, что число молей иона Ва2+ равно числу молей BaCO3, которые вступили в реакцию диссоциации. Следовательно, в 10 л раствора масса (BaCO3) = 2×10–5 ×10×197,35 = 0,0394 г = 39,4 мг.
= 2×10–5 (моль /л), т.е. в 1 л раствора содержится 2×10–5 моля иона Ва2+. Из уравнения диссоциации барита следует, что число молей иона Ва2+ равно числу молей BaCO3, которые вступили в реакцию диссоциации. Следовательно, в 10 л раствора масса (BaCO3) = 2×10–5 ×10×197,35 = 0,0394 г = 39,4 мг.
(197,5 молярная масса BaCO3). Ответ: 39,4 мг
Задача. После выпаривания воды из 15,0 г раствора Ag3PO4получено
0,0001г безводной соли. Вычислить ПР(Ag3PO4).
Решение: запишем выражение для ПР соли: Ag3PO4 = 3 Ag+ + PO43−, ПР =
[Ag+]3×[PO43−] Вычислим молярную концентрацию соли в растворе: 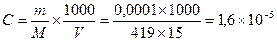 M. Следовательно, [Ag+] =3×1,6×10−5,
M. Следовательно, [Ag+] =3×1,6×10−5,
[PO43−] = 1×1,6×10−5, ПР(Ag3PO4) = 1,8×10−18.
Задача. Оценить растворимость флюорита CaF2, если ПР(CaF2) = 2,14×10−12.
Решение: реакция диссоциации флюорита: CaF2 = Ca2+ + 2F−. Пусть флюорита растворилось n(молей). Тогда в растворе будет n(моль) Са2+ и 2n(моль) F−. ПР(CaF2) = [Ca2+]1×[F−]2 = n×4n2 = 4n3. 4n3 = 2,14×10−12; n ≈ 8,2×10−5 моля. M(CaF2) = 78. 8,2×10−5 ×78=6,4 мг.
В 1000 г воды растворится 6,4 мг флюорита.
Задача. Раствор содержит нитраты кадмия и железа(II) в равных концентрациях. Гидроксид какого элемента выпадет в осадок первым при добавлении щелочи, если ПР(Cd(OH)2) = 2×10−14, ПР(Fe(OH)2) = 1×10−15. Каким должно быть соотношение концентраций нитратов, чтобы при добавлении щелочи
оба гидроксила начали выпадать в осадок одновременно?
Решение: гидроксид того элемента выпадет в осадок первым, ПР которого меньше, т.е. первым в осадок выпадет гидроксид железа. Чтобы оба гидроксида начали выпадать в осадок одновременно, надо чтобы концентрация вводимой щелочи удовлетворяла одновременно обоим значениям ПР. Следовательно, равновесная концентрация ионов ОН− в растворах гидроокиси кадмия и железа должна быть одинаковой:
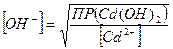 ;
; 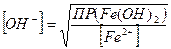 Эти концентрации будут равны,
Эти концентрации будут равны,
если 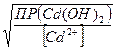 =
= 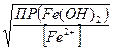 , или
, или 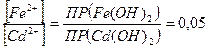 , т.е. если концентрация ионов железа, будет в 20 раз меньше, чем ионов кадмия.
, т.е. если концентрация ионов железа, будет в 20 раз меньше, чем ионов кадмия.
 2015-06-05
2015-06-05 3625
3625








