Принципиальная схема производства аммиака
Химическая схема производства аммиака
С
С
СН4 + Н2О «СО + 3Н2, DН0298 = 206,2 кДж;
СО + Н2О «СО2 + Н2, DН0298= — 41,2 кДж.
Водород получают также неполным окислением углеводородов, например:
2СН4 + О2 = 2СО + 4Н2, DН0298= —71,3 кДж.
Основная стадия получения аммиака из азотоводородной смеси описывается уравнением:
N2 + 3H2 = 2NH3
Однако, так как преобладающим методом получения АВС является конверсия метана воздухом и водяным паром, химическая схема производства аммиака помимо этой реакции включает несколько реакций воздушной и паровой конверсии, а также ряд других физико-химических операций.
Первая стадия - приготовление АВС.
Вторая стадия – синтез аммиака из АВС.
В свою очередь, каждая стадия состоит из нескольких операций.
На рисунке 4.4 представлена принципиальная схема производства аммиака.
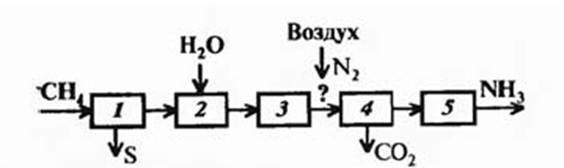
Рисунок 4.4 – принципиальная схема производства аммиака.
1. очистка природного газа от серосодержащих соединений;
2. конверсия метана;
3. конверсия оксида углерода;
|
|
|
4. очистка водорода от оксидов углерода, добавление азота к водороду;
5. синтез аммиака
Рассмотрим подробнее каждый из этапов синтеза.
Основными химическими синтеза аммиака являются:
Поскольку конверсия природного газа – каталитический процесс, перед проведением конверсии проводят очистку природного газа от соединений серы, являющихся каталитическими ядами. Кроме того, наличие в природном газе соединений серы вызывает коррозию аппаратуры. Природный газ содержит примеси серосодержащих соединений - меркаптаны (RSH), тиофен (гетероциклическое соединение C4H4S), сероуглерод (CS2), сульфиды (R2S), сероводород (H2S) и др. Кроме того, природный газ перед транспортировкой ОДОРИРУЮТ - добавляют этилмеркаптан, обладающий сильным запахом. Одорирование придает специфический запах природному газу (метан - газ без запаха). Это делается в целях безопасности - утечка взрывоопасного газа должна ощущаться окружающими. Содержание серы невелико, в среднем - несколько десятков мг/м3. Но сера в любом виде отравляет катализаторы, используемые в производстве аммиака. Ее содержание не должно превышать 0,5 мг S/m3.
Для очистки от малых количеств примесей эффективны сорбционные методы, но различные компоненты удаляются разными, специфичными сорбентами. Чтобы избежать многоступенчатой сорбционной сероочистки, все серосодержащие соединения сначала "приводят" в одно состояние - их гидрируют до сероводорода:
RSH + Н2 = H2S + R;
C4H4S + 4Н2 = H2S + C4H10;
CS2 + 4H2 = H2S + СН4 и т. д.
Водород для гидрирования в виде азотоводородной смеси имеется в производстве аммиака. Его добавляют до 15%. Кобальт-молибденовый катализатор активен в этих реакциях при 670 К. Выходящий из реактора гидрирования газ содержит серу только в виде H2S и направляется в абсорбер, в котором и происходит собственно очистка газа. Технологическая схема очистки природного газа от серы показана на рис. 4.5.
|
|
|
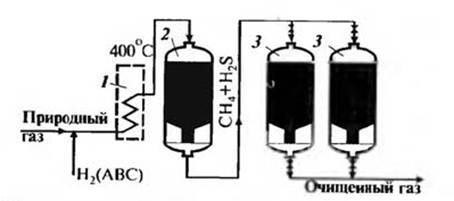
Рис. 4.5 – Технологическая схема очистки природного газа от серусодержащих соединений. 1 – огневой подогреватель; 2 – реактор гидрирования; 3 – абсорберы; ABC - азотоводородная смесь
В качестве поглотителя сероводорода используется оксид цинка ZnO:
ZnO + H2S = ZnS + H2O.
2. Приготовление АВС:
Основным методом получения АВС является каталитическая конверсия метана с целью получения водорода.
Сырьём для этого метода служит природный газ, содержащий 90-98% метана.
Парокислородная (парокислородовоздушная) конверсия метана проводится в два этапа.
Первый этап: окисление метана водяным паром, кислородом (либо воздухом) и оксидом углерода (II) Взаимодействие протекает на никельсодержащем катализаторе и может быть представлено следующими процессами:
CH4 + H2O = CO + 3H2 – Q с поглощением тепла
CH4 + 0,5O2 (N2) = CO + 2H2 (N2) + Q с выделением тепла (малым)
CH4 + CO2 = 2CO + 2H2 – Q с поглощением тепла????
Процесс называется парокислородной конверсией, если в качестве окислителей природного газа используется водяной пар и кислород, парокислородовоздушной – если в качестве окислителя используют водяной пар, кислород и воздух.
Второй этап: последующее превращение оксида углерода (II) в оксид углерода (IV) (конверсия оксида углерода):
CO + H2O = H2 + CO2 + Q – с выделением тепла
Первый из этапов - эндотермический, второй - экзотермический. Температура будет по-разному влиять на их равновесие: благоприятно - для первой и отрицательно - для второй реакций. Поскольку сначала надо обеспечить наиболее полное превращение метана, то температуру процесса целесообразно повышать. При этом равновесие второй реакции сдвигается влево.
При этом тепло, выделяемое на втором этапе конверсии, используется для проведения первого этапа – пример рационального использования вторичных энергетических ресурсов в химической технологии.
Применение давления существенно снижает полноту конверсии, так как реакция идет с увеличением объема.
И парокислородная, и парокислородовоздушная конверсии нашли применение в промышленной практике. При проведении парокислородной конверсии получают безазотистый конвертированный газ СО2 + Н2, при проведении парокислородной конверсии – конвертированный газ, содержащий азот в таком количестве, которое необходимо для получения стехиометрической азотоводородной смеси для синтеза аммиака, т.е. 75 % водорода и 25 % азота.
Азотводородная смесь, независимо от метода её получения, содержит примеси веществ, которые являются каталитическими ядами, вызывающими как необратимое, так и обратимое отравление катализатора.
Необратимое отравление катализатора вызывают различные соединения серы и фосфора.
Обратимое отравление катализатора вызывают кислород, оксиды углерода, пары воды.
 2014-02-24
2014-02-24 5419
5419








