Электрогравиметрия относится к старейшим электроаналитическим методам, широко используемым для определения ионов металлов. В настоящее время ее применяют прежде всего для электровыделения металлов из сложных смесей. Анализ основан на электролизе растворов, содержащих соли переходных металлов и осаждении высокочистых металлов на катоде.
Количественные соотношения электролиза установлены Фарадеем (1827 г.). Согласно его закону масса прореагировавшего на электроде вещества m (г) пропорциональна затраченному количеству электричества:
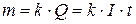 , , |
где Q – количество электричества, Кл; k – электрохимический эквивалент, г/Кл; I – сила тока, А; t – продолжительность электролиза, с.
Электрохимический эквивалент рассчитывают из соотношения
 , , |
где М – молярная масса окислителя или восстановителя; n – число электронов, участвующих в полуреакции на данном электроде; F – постоянная Фарадея (96485 Кл/моль).
Для улучшения методики используют потенциостат, позволяющий измерять потенциал катода относительно электрода сравнения. Процесс электролиза можно вести при контролируемом токе или контролируемом потенциале. В качестве катода используют платиновую сетку или фольгу. Металлы, образующие амальгамы, можно осаждать на ртутных электродах.
 2015-01-30
2015-01-30 984
984








