Пути передачи сигналов, индуцирующих экспрессию генов при солевом стрессе, только начинают изучаться. В подразд. 8.2.5 был рассмотрен путь сигнальной трансдукции, включающий гистидинкиназу и МАР-киназный каскад и ответственный за биосинтез осмолитов при осмотическом стрессе. Эти же механизмы участвуют в нейтрализации осмотического эффекта солей, так как включаются неспецифически в ответ на действие любого осмотика. При солевом стрессе помимо индукции синтеза белков, вовлеченных в биосинтез осмолитов, активируются системы ионного гомеостатирования. Поглощенные клеткой ионы Na+ должны быть выведены обратно в наружную среду или компар-тментализованы в вакоули. Это требует активации
Na+-нacocoв ПМ и тонопласта. Показано, что экспрессия SOS1 — гена Na+/H+-антипортера ПМ, и NHX — гена Na+/H+-антипортера тонопласта, у A. thaliana индуцируются специфически высокими концентрациями солей. Для путей передачи сигнала, индуцирующих экспрессию генов при солевом стрессе, идентифицировано несколько транскрипционных факторов и промоторных элементов.
|
|
|
Недавно у A. thaliana был открыт специфический для Na+-стрecca АБК-независимый SOS-путь передачи сигнала, приводящий к экспрессии гена Nа+/Н+-антипортера ПМ SOS1 (рис. 8.21).
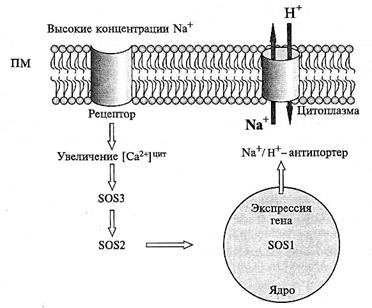
Рис. 8.21. SOS-путь передачи сигнала при индукции биосинтеза Na+/H+-антипортера высокими концентрациями Na+ в среде (по J.-K. Zhu, 2000, с изменениями).
Высокие концентрации Na+ приводят к увеличению концентрации Са2+ в цитозоле. Са2+-зависимая протеинфосфатаза, кальцинейрин (S0S3) связывает Са2+ и активирует протеинкиназу, кодируемую геном S0S2. Образующийся комплекс SOS2 —S0S3 индуцирует экспрессию гена Na+/ Н+-антипортера S0S1. SOS-путь, по-видимому, отвечает также за регуляцию активности S0S1 и, возможно, других ион-транспортирующих систем при солевом стрессе на пост-трансляционном уровне. Экспрессия гена S0S1 и регуляция ион-транспортной активности обеспечивают поддержание ионного гомеостаза при стрессе и вносят вклад в солеустойчивость растений
SOS-путь включает белок кальцинейрин (SOS3), который является Са2+- и кальмодулинзависимой протеинфосфатазой. Этот фермент состоит из каталитической А-субъединицы (СnА) и регуляторной В-субъединицы (СnВ) и имеет три EF-лиганда, связывающих Са2+. Полная активация фермента нуждается в образовании комплексов Са2+-СnВ, и Са2+-кальмодулин. В состав SOS-цепи передачи сигнала входит также серин/треонин-протеинкиназа, кодируемая геном SOS2. При функционировании SOS-пути рецептор неизвестной природы воспринимает сигнал (высокие концентрации Na+), что приводит к возрастанию концентрации свободного Са2+ в цитозоле. SOS3 связывает Са2+ и активирует протеинкиназу SOS2, образуя протеинкиназный комплекс SOS2 —SOS3. Активированная протеинкиназа фосфорилирует белки, непосредственно вовлеченные в экспрессию SOS1, а также других генов, в том числе ответственных за транспорт К+. SOS-путь может также регулировать активность других транспортных белков на посттрансляционном уровне.
|
|
|
Следует отметить важную роль в сигнальной трансдукции при NaCI- стрессе цитоплазматического Са2+. Наряду с участием в передаче сигнала через SOS-путь ион Са2+ выполняет функцию вторичного мессенджера в сигнальных путях, включающих протеинкиназы, которые содержат Са2+-связывающий домен, подобный Са2+-связывающему домену в молекуле кальмодулина. Один из механизмов, приводящих к возрастанию концентрации Са2+ в цитоплазме, связан с образованием инозитол-1,4,5-трифосфата, который освобождает Са2+ из вакуолярного компартмента. Другой механизм основан на активации потенциалзависимых Са2+-каналов при NaCl-индуцированной деполяризации ПМ и входе в клетку содержащегося в апопласте свободного Са2+. Экспрессия генов NaCl-индуцируемых белков и регуляция транспортной активности продуктов этих генов обеспечивают поддержание ионного гомеостаза при стрессе, что наряду с другими механизмами повышает устойчивость растения к NaCI.
Хорошо изучена индукция гена Na+-АТФазы плазмалеммы (ENA1) у дрожжей S. cerevisiae. Индукция осуществляется двумя независимыми механизмами. При относительно низких концентрациях NaCl (0,1 — 0,3 М) сигнал передается через МАР-киназный путь — систему, активируемую неспецифически различными осмотиками (см. подразд. 8.2.5). Недавно транскрипционный фактор Scol был идентифицирован как репрессор ENA1. Инактивируя Scol, осмотик через МАР-киназный путь индуцировал экспрессию ENA1. Этот случай интересен как пример негативной регуляции, при которой стрессор снимает действующую в дострессовых условиях репрессию. Предполагается, что такого рода негативная регуляция осуществляется при экспрессии многих защитных генов.
Индукция ENA1 при высоких концентрациях NaCl (0,6 — 1,0 М) осуществляется через
Са2+-активируемый SOS-путь с участием кальцинейрина (рис. 8.22). Последний представляет собой важный детерминант солеустойчивости дрожжей, так как осуществляет положительную регуляцию гена Nа+-транспортирующей АТФазы ENA1, а также гена высокоафинного транспортера К+ Trkl.
Как отмечалось выше, степень устойчивости растений к действию стрессора характеризуется обратной корреляцией со скоростью роста. Антагонистические отношения между процессами роста и акклимации реализуются через сеть путей сигнальной трансдукции. Такого рода сеть в упрощенном виде представлена на рис. 8.22.
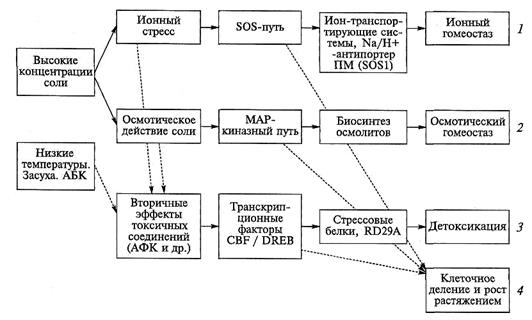
Рис. 8.22. Пути передачи сигналов при экспрессии генов, отвечающих за (7) поддержание ионного гомеостаза, (2) оводненности клеток, (3) детоксикацию и (4) регуляциюростовых процессов (по J.-K.Zhu, 2001, с изменениями).
Через SOS-путь передаются сигналы, активирующие биосинтез ион-транспортирующих белков, например NaVtT-антипортера ПМ (S0S1). МАР-киназный путь отвечает за индукцию биосинтеза осмолитов и соответственно за регуляцию осмотического и тургорного давления. Первичные стрессы, ионный и осмотический, индуцируют вторичные стрессы, связанные с образованием токсичных соединений, например АФК. Некоторые белки, индуцируемые засухой, засолением или низкими температурами, обеспечивают устойчивость к вторичным стрессам. К ним относится, в частности, белок Lea-типа, кодируемый геном RD29A. Эти белки участвуют в детоксикациии и предотвращают повреждения биополимеров. Транскрипционные факторы CBF/ DREB регулируют экспрессию генов, вовлеченных в детоксикацию. Регуляция ионного гомеостаза, осмотического гомеостаза и детоксикации сопряжена с регуляцией клеточного деления и роста растяжением
|
|
|
Из многообразия ответных реакций растения на высокие концентрации соли виден полигенный характер солеустойчивости. Согласованное функционирование защитных систем, которые включаются в ответ на повышение наружной концентрации соли, следует рассматривать в трех взаимосвязанных аспектах: 1) гомеостаз должен быть восстановлен в новых стрессовых условиях; 2) молекулярные повреждения должны быть устранены; 3) рост должен быть возобновлен, хотя и с меньшей скоростью.
 2015-06-14
2015-06-14 813
813








