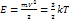
 √(V2) = √(3*k*T/m) = √(3*R*T/μ) – средняя квадратичная скорость
√(V2) = √(3*k*T/m) = √(3*R*T/μ) – средняя квадратичная скорость
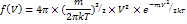
f(V) – функция распределения молекул по скоростям, т.е. относительное число молекул, скорости которых лежат в интервале от V до V+dV.
df(V)/dV = 0
 Vв = √(2*R*T/μ) – вероятная скорость
Vв = √(2*R*T/μ) – вероятная скорость
 Vа = √(8*R*T/(π*μ)) – средняя арифметическая скорость
Vа = √(8*R*T/(π*μ)) – средняя арифметическая скорость

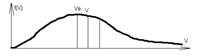 |
Площадь под кривой пропорциональна числу молекул. При повышении температуры максимум смещается вправо, а площадь остаётся постоянной.
Классическая теория теплоёмкости кристаллов. Закон Дюлонга и Пти.
C = dU/dT
Кристалл – система с 3N колебательными степенями свободы, на каждую из которых приходится E=k*T энергии.
Uμ = 3*NA*E = 3*NA*k*T
Cμ = 3R – закон Дюлонга и Пти – молярная теплоёмкость химически простых кристаллов равна 3R.
Билет №7.
 2015-06-24
2015-06-24 403
403








