Na/K-АТФаза - фермент клеточной мембраны животных тканей, который избирательно выкачивает из клетки ионы натрия и аккумулирует в ней ионы калия, используя для этой работы энергию АТФ. Создаваемая ферментом разница концентраций одновалентных катионов используется для протекания ключевых реакций жизнедеятельности - генерации возбуждения, водно-солевого обмена, а также для регуляции клеточного метаболизма.
Активный транспорт ионов против их концентрационного градиента зависит от наличия в клетке АТФ. В нейронах мозга, например, на его осуществление затрачивается до 30% всего фонда аденозинтрифосфата, причем спящий мозг расходует на поддержание разницы в распределении одновалентных катионов внутри и вне нейронов почти столько же энергии, сколько и бодрствующий. Na/K-ATФаза. Она представляет собой сложный белок, встроенный в наружную мембрану клетки и имеющий центры связывания для ионов натрия и калия, а также активный центр, где осуществляются связывание и гидролиз АТФ.
|
|
|
Функциональная единица фермента состоит из двух полипептидных цепей: большей (альфа-субъединицы) и меньшей (бета-субъединицы), входящих в состав ферментного комплекса в соотношении 1: 1. Меньшая субъединица пересекает мембрану только один раз, в то время как большая - много раз, образуя несколько петель, при этом оба конца пептидной цепи обращены в цитоплазму. Активный центр фермента обращен в цитоплазму и доступен для цитоплазматического АТФ. Центры связывания переносимых ионов локализованы в петле между второй и третьей спиралями, пронизывающими мембрану. Таким образом, альфа-субъединица может выполнять функцию насоса независимо от бета-субъединицы. Однако оба полипептида образуют компактную глобулу, насквозь пронизывающую мембрану.
Та часть бета-субъединицы, которая обращена во внеклеточную среду, несет на себе ковалентно присоединенные углеводные фрагменты. По массе и наличию углеводов этот полипептид можно отнести к лектинам - мембранным гликопротеинам, которые отвечают за межклеточное узнавание и адгезию. В процессе белкового синтеза обе субъединицы встраиваются в мембрану одновременно. Существует мнение, что бета-субъединица обеспечивает правильную ориентацию альфа-субъединицы в мембране.
Одно из неотъемлемых свойств живой клетки - способность реагировать на повреждение. Ионная асимметрия является условием этой реакции, и, вероятно, калий и натрий выбраны живыми системами как своеобразные индикаторы повреждения мембраны из-за их повсеместного распространения. Но зачем клетка концентрирует калий и выбрасывает натрий, а не наоборот? Натрий и калий в ионизированном состоянии не отличаются друг от друга по заряду и числу создаваемых ими координационных связей, но существенно отличаются по величине предельной температуры, то есть той температуры, выше которой разрешена их гидратация. Для натрия она составляет +20°С, а для калия +70°С. По крайней мере в диапазоне температур выше +20°С, в котором функционируют большинство живых организмов, натрий легко взаимодействует с молекулами воды, образуя гидратную оболочку, а калий отталкивает воду и потому лишен гидратной оболочки. Таким образом, ион калия по своим свойствам является более гидрофобным, чем ион натрия.
|
|
|
Поскольку гидратированный ион натрия близок по размерам к негидратированному иону калия, то ни по заряду, ни по размерам эти ионы не отличаются друг от друга и наиболее существенным различием для их дискриминации является величина гидрофобности. Липиды хорошо различают Na+ и K+, вероятно, именно благодаря различиям в их гидрофобности. Если приготовить везикулы из смеси природных липидов (такой упрощенный прообраз клеточных структур называют липосомами), оказывается, что скорость простой диффузии через их мембраны будет в 3-7 раз выше для калия, чем для натрия (в зависимости от состава липидов, ионной силы и других условий). Таким образом, "неживые" липосомы способны создавать градиент одновалентных ионов на своей мембране, похожий на тот, что создается живыми клетками.
Нуклеиновые кислоты, несущие информацию о синтезе белков и этим определяющие белковое "лицо" клетки, тоже реагируют на изменение ионного состава среды, в которой они функционируют. Так, ионы натрия влияют на упаковку и взаимодействие нуклеотидов в двойной спирали, а ионы калия регулируют прочность контактов между рибосомами и РНК, с участием которых происходит синтез полипептидной цепи. Белковые молекулы также не являются исключением. Они способны различать натрий и калий в водных растворах. Интенсивность многих ферментативных процессов в клетке зависит от ионов натрия и калия: в большинстве случаев ион калия является активатором, а ион натрия - ингибитором клеточных реакций. Исключение составляют процессы синтеза липидов, активируемые натрием. Таким образом, повреждение клеточной мембраны и увеличение соотношения Na / K в клетке ускоряют образование липидов, необходимых для репарации мембраны.
Специфическим механизмом распознавания ионов калия и натрия обладает Na/K-АТФаза. Она обеспечивает активный транспорт ионов Na и K через клеточную мембрану, осуществляя гидролиз АТФ, и использует этот процесс как источник энергии для переноса ионов Na и K против их концентрационных градиентов. Изменение соотношения Na / K в реакционной среде специфически изменяет активность фермента. Оптимум активности приходится на 130 мМ Na+ и 20 мМ K+ при их сумме 150 мМ, типичной для нервных клеток.
Однако в покоящейся клетке соотношение концентраций ионов натрия и калия противоположно тому, которое необходимо для максимальной активности Na / K-АТФазы. В этих условиях она составляет лишь 10-12%. Однако стоит немного повредить клеточную мембрану или другим способом активировать вход в клетку натрия и выход из нее калия, как произойдет активация АТФазы и ее работа будет восстанавливать ионную асимметрию. Таким образом, Na / K-ATФаза работает в клетке как молекулярная машина по перекачке ионов натрия и калия, поэтому ее также называют Na / K-насосом.
Гидролизуя АТФ, чтобы обеспечить энергией активный транспорт ионов,
Na / K-ATФаза осуществляет сложную многостадийную реакцию, в которой участвуют ионы натрия, калия и магния, а также АТФ. Фермент имеет лабильную структуру. Он легко изменяет свою конформацию в зависимости от того, какой ион к нему присоединяется. Начинается гидролитический цикл с взаимодействия белка с ионами натрия. "Натриевая" конформация фермента (или Na-конформер) обозначается как Е1. Конформация, обладающая высоким сродством к калию, обозначается как Е2 (К-конформер). 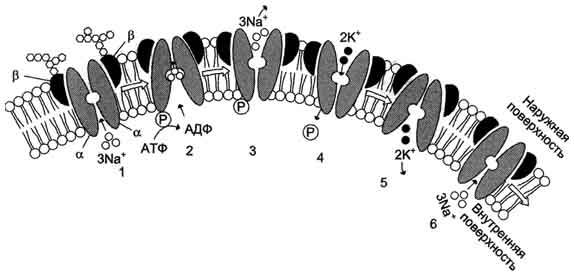
|
|
|
Строение и функционирование Nа+,К+-АТФ-азы плазматической мембраны. 1 - три иона натрия связываются специфическим центром транслоказы; 2 - изменение конформации транслоказы, вызванное присоединением 3Na+, приводит к активации каталитической субъединицы и увеличению сродства активного центра к субстрату (АТФ). Протекает реакция аутофосфорилирования по карбоксильной группе аспарагиновой кислоты; 3 - аутофосфорИлирование изменяет заряд и конформа-цию транслоказы, она закрывается с внутренней стороны мембраны и открывается с наружной, уменьшается сродство к ионам натрия и они диссоциируют от переносчика; 4 - Na+, К+-АТФ-аза открытая с наружной стороны мембраны имеет специфический центр связывания для 2К+; Присоединение двух ионов калия к фосфорилированной транслоказе вызывает изменение конформации и появление аутофосфатазной активности. Протекает реакция аутодефосфорилирования; 5 - дефосфорилирование изменяет заряд и конформацию транслоказы, она закрывается с наружной стороны мембраны и открывается с внутренней, уменьшается сродство к ионам калия и они диссоциируют от Na+, К+-АТФ-азы; 6 - АТФ-аза возвращается в первоначальное состояние.
1. Когда фермент находится в состоянии Е1, он способен взаимодействовать с ионами натрия и AТФ с внутренней стороны мембраны. В результате фосфорилирования молекулы образуется Е1-Р, а АДФ высвобождается из активного центра и возвращается в цитоплазму.
2. Фосфорилированный белок переходит в состояние, при котором ионы натрия не способны высвобождаться ни по внутреннюю, ни по внешнюю стороны мембраны - они недоступны для обмена.
3. Переход фермента в следующую стадию существенно активируется ионами магния. Хотя специальных центров связывания магния на молекуле фермента не обнаружено, его эффект очень важен - он заключается в ускорении перехода фосфорилированного фермента из конформации Е1 в конформацию Е2. Эта стадия отражает молекулярные перемещения отдельных частей белковой глобулы, связанные с непосредственным переносом ионов натрия через мембрану Na / K-насосом. Таким образом, перенос натрия через мембрану осуществляется синхронно с конформационным переходом Е1 Е2. Вследствие этого конформационного перехода центр связывания ионов становится более гидрофобным, и ионы натрия диссоциируют от фермента по другую сторону мембраны, где с этим же центром связываются ионы калия.
|
|
|
4. Калий подвергается такой же окклюзии, что и натрий, в ходе этого процесса осуществляется перенос ионов калия через мембрану.
5. Комплекс Е2Р отличается от своего предшественника тем, что окружение фосфатной группировки становится более гидрофильным. Фосфат оказывается доступным для атаки молекулой воды. Происходят водный гидролиз Е-Р (дефосфорилирование фосфофермента) и высвобождение неорганического фосфата во внутриклеточную среду.
6. После этого ионы калия также диссоциируют от центра связывания, высвобождаясь в цитоплазму. Их место занимает натрий. Последняя стадия цикла одновременно подготавливает фермент для начала нового цикла - конформер Е2 превращается в конформер Е1. Этот процесс ускоряется АТФ, повышающим сродство фермента к натрию и понижающим его сродство к калию.
Так происходит активный транспорт ионов натрия из клетки и калия в клетку, а энергия АТФ тратится на оплату перехода фермента из одной конформации в другую. Таким образом, в ходе ферментативного процесса перенос ионов натрия и калия осуществляется одним и тем же ионным центром фермента, последовательно изменяющим свое сродство к переносимым ионам при изменении конформации Na / K-АТФазы.
Ионные центры фермента расположены в петле между 2-м и 3-м альфа-спиральными участками фермента, пересекающими мембрану. Взаимодействие ионов с этими центрами обеспечивается благодаря координационным связям с атомами кислорода, принадлежащими дикарбоновым аминокислотам белка - аспарагиновой и глутаминовой. Кислород способен осуществлять координационные взаимодействия с лигандами, образуя решетку двух типов. В одном случае получается рыхлая и доступная для молекул воды структура, а в другом атомы упакованы более плотно. В первом случае ионный центр может связать три иона натрия, а во втором - два иона калия. Этим и объясняется тот факт, что при гидролизе одной молекулы ATФ фермент обменивает три иона натрия на два иона калия. В образовании координационных связей с ионами принимают участие 12 атомов кислорода карбоксильных групп дикарбоновых аминокислот белка - глутаминовой и аспарагиновой, расположенных в петле между 2-й и 3-й колоннами альфа-субъединицы, пересекающими мембрану. Точная упаковка этой петли не установлена, однако показано, что в ее состав входят 15 дикарбоновых аминокислот, так что выбор групп для образования центра связывания ионов вполне достаточен. Конформационная перестройка, претерпеваемая белком при переходе Е1 Е2, обеспечивает перестройку ионных центров и последующее перемещение петли, содержащей центр связывания ионов, внутрь мембраны. Это приводит к изменению сродства к переносимым ионам и одновременно делает ионный центр доступным для внешней или внутренней среды. Отдельные функциональные единицы фермента в мембране (протомеры) образуют более крупные ансамбли из нескольких молекул, называемые олигомерами.
Известно, что Na / K-АТФаза может гидролизовать и другие нуклеотиды - ГТФ, УТФ - и обеспечивать в ходе этой реакции активный транспорт ионов натрия и калия. Однако скорость такой реакции мала. Если при использовании метода молекулярной мишени взять в качестве субстрата не АТФ, а ГТФ, то обнаруживаемые размеры фермента окажутся равны размерам одного (альфа + бета)-протомера. На основании этих результатов был сделан вывод, что при гидролизе АТФ фермент способен объединяться в олигомерные ансамбли, состоящие из нескольких протомеров.
Сопоставление скоростей реакции, катализируемой ферментом, работающим в виде олигомерного ансамбля (при гидролизе АТФ) или в виде независимых протомеров (при гидролизе ГТФ), показывает, что, объединяясь в ансамбли, молекулы фермента увеличивают скорость функционирования. В этом и заключается биологическое значение олигомерной структуры фермента. Интересно, что олигомеры образуются лишь в случае использования АТФ. Это показывает, что кроме роли источника энергии ATФ может выполнять в клетке дополнительную регулирующую роль, которая заключается в объединении отдельных протомеров Na / K-АТФазы в олигомерный ансамбль.
Активность Na / K-АТФазы в клетке регулируется многими факторами. На первом месте стоят соотношение Na / K и доступность ATФ - это факторы так называемой краткосрочной регуляции активности. Содержание ATФ в клетке, как правило, мало изменяется в нормальных условиях, хотя может резко снижаться при патологических нарушениях. В таком случае снижение уровня ATФ будет критическим для поддержания достаточной активности Na / K-насоса. В клетке Na / K-ATФаза подвергается фосфорилированию рядом протеинкиназ (ферментов, которые переносят терминальный фосфат ATФ на белки-мишени и тем самым модифицируют их активность). Эти фосфорилирующиеся участки расположены вне активного центра. По некоторым наблюдениям, фосфорилирование Na / K-ATФазы протеинкиназами уменьшает ее активность. К долгосрочным механизмам можно отнести и гормональную регуляцию синтеза Na / K-АТФазы, осуществляющуюся на уровне генетического аппарата (например, активацию синтеза фермента гормоном, регулирующим минеральный обмен, - альдостероном).
Интересную проблему представляет ингибирование Na / K-ATФазы сердца уабаином и другими сердечными гликозидами. Механизм действия уабаина и родственных ему алкалоидов растительного происхождения на организм человека и животных был долгое время неясным, хотя их длительное применение в медицине в качестве кардиотонических препаратов оправдывало присвоение им названия сердечных гликозидов. Изоформа
Na / K-АТФазы, обнаруживаемая в клетках сердца, гораздо более чувствительна к уабаину, чем, например, изоформа фермента, обнаруживаемая в почечной ткани.
Ингибирование Na / K-АТФазы сердечной мышцы приводит к усилению сердечных сокращений, то есть к положительному инотропному эффекту. Более того, частичное ингибирование Na / K-насоса сердца вызывает усиление синтетических процессов в миокарде и увеличение мышечной массы, что важно для увеличения эффективности работы сердечной мышцы. Почему же Na / K-АТФаза сердца животных обладает избирательной чувствительностью к соединениям, являющимся типичными представителями растительного мира?
В мембране сердечных клеток (кардиомиоцитов) кроме Na / K-насоса имеются и другие белки, включающиеся в регуляцию ионного гомеостаза. Важную роль играет специальный белок-переносчик, который способен осуществлять обмен через мембрану миоцита ионов натрия на ионы кальция, - Na / Ca - обменник. Он может пополнять запасы ионов кальция, участвующих в мышечном сокращении. Но это возможно лишь при наличии внутри клетки ионов натрия, концентрацию которых можно повысить в результате ингибирования Na / K-насоса. Так, благодаря действию сердечных гликозидов в кардиомиоцитах восстанавливается содержание ионов кальция, регулирующих сократительную активность.
Было естественно предположить, что действие уабаина имитирует эффект природных соединений, вырабатываемых животным организмом и циркулирующих в кровяном русле. Действительно, сыворотка крови человека обладает выраженной способностью ингибировать Na / K-АТФазу. Ингибирующий эффект сыворотки повышается у пациентов с нарушениями водно-солевого обмена, что наблюдается при гипертонии. Исследования показали, что стероидные соединения, подобные уабаину, вырабатываются и служат для регуляции активности Na / K-АТФазы в организме человека и животных. В настоящее время обнаружены также пептидные ингибиторы
Na / K-АТФазы, биологические эффекты которых направлены на регуляцию активности этого фермента в сердце, почках и других тканях. Наличие множественных путей регуляции подтверждает важность Na / K-АТФазы для метаболизма клетки.
Са2+-АТФ-аза
В цитозоле "покоящихся" клеток концентрация Са2+ составляет ~10-7 моль/л, тогда как вне клетки она равна ~2∙ 10-3 моль/л. Поддерживает такую разницу в концентрации система активного транспорта ионов кальция; ее основные компоненты - кальциевые насосы - Са2+-АТФ-азы и Na+,Ca2+-обменники.
Са-АТФаза - не один фермент, а группа кальциевых АТФаз, различающихся по локализации в клетке, строению и способу регуляции. Но все эти ферменты переносят ионы кальция из клеточного сока во внеклеточную жидкость или внутриклеточные депо кальция - пузырьки эндоплазматического ретикулума за счет энергии гидролиза АТФ, поддерживая тем самым низкую концентрацию ионов кальция в цитоплазме.
Этот процесс в цитоплазме покоящихся клеток создает возможность регуляции клеточных функций путем увеличения проницаемости клеточных мембран для Ca2 +: входя в клетку, эти ионы активируют великое множество различных внутриклеточных процессов. Яркий пример - сокращение мышцы, которое начинается с выхода ионов кальция из саркоплазматического ретикулума и его взаимодействия с сократительными белками. Последующее удаление Ca2+ из цитоплазмы и накопление его в емкостях эндоплазматического ретикулума осуществляются Са-АТФазой и приводят к расслаблению мышцы. В других клетках ионы кальция, входя пассивно через открывающиеся каналы, связанные с различными рецепторами, также играют роль посланников, дающих приказы включить ту или иную внутриклеточную систему. После исполнения приказа "посланников" надо выпроводить из цитоплазмы, что и делают Са-АТФазы, а также Na+-Ca2 +-обменники.
Кальциевые АТФазы, входящие в состав цитоплазматических мембран и внутриклеточных мембран, различаются по ряду свойств. Все Са-АТФазы представляют собой мономерные белки, то есть состоят из единственной полипептидной цепи, но несколько различаются по молекулярной массе.
Са2+-АТФ-аза локализована не только в плазматической мембране, но и в мембране ЭР. Фермент состоит из десяти трансмембранных доменов, пронизывающих клеточную мембрану. Между вторым и третьим доменами находятся несколько остатков аспарагиновой кислоты, участвующих в связывании кальция. Область между четвёртым и пятым доменами имеет центр для присоединения АТФ и аутофосфорилирования по остатку аспарагиновой кислоты. Са2+-АТФ-азы плазматических мембран некоторых клеток регулируются белком кальмодулином. Каждая из Са2+-АТФ-аз плазматической мембраны и ЭР представлена несколькими изоформами.
Работа Са2+-АТФ-азы цитоплазматической мембраны по стадиям представлена на рис.
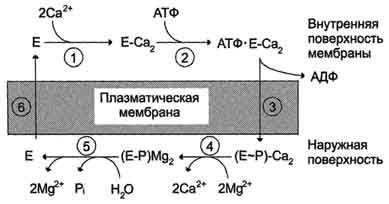
Последовательность событий в процессе работы Са2+-АТФ-азы. 1 - связывание двух ионов кальция участком АТФ-азы, обращённой в цитозоль; 2 - изменение заряда и конформации фермента (АТФ-азы), вызванное присоединением двух ионов Са2+, приводит к повышению сродства к АТФ и активации аутофосфорилирования; 3 - аутофосфорилирование сопровождается информационными изменениями, АТФ-аза закрывается с внутренней стороны мембраны и открывается с наружной; 4 - происходит снижение сродства центров связывания к ионам кальция и они отделяются от АТФ-азы; 5 - аутодефосфорилирование активируется ионами магния, в результате Са2+-АТФ-аза теряет фосфорный остаток и два иона Мg2+; 6 - АТФ-аза возвращается в исходное состояние.
Na+,Ca2+-обменники плазматической мембраны (активный антипорт), ионы натрия по градиенту концентрации переносятся в клетку, а ионы Са2+ против градиента концентрации выходят из клетки
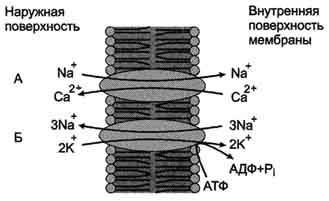
Натрий-зависимый транспорт ионов кальция. A - Na+-зависимый переносчик ионов кальция; Б - Na+, К+-АТФ-аза.
При гидролизе одной молекулы АТФ Са-АТФаза переносит два иона кальция из окружающей среды внутрь везикул. Перенос ионов кальция сопровождается переносом электрических зарядов, но разность потенциала на мембране не удерживается, потому что мембрана хорошо проницаема для других ионов.
В работе фермента стадии переработки АТФ как бы чередуются со стадиями переноса Ca2 +.
1) связывание двух ионов кальция на поверхности АТФазы, обращенной в цитоплазму (или наружу в изолированных пузырьках СР);
2) связывание на той же поверхности молекулы АТФ;
3) фосфорилирование белка (образование фосфофермента) и высвобождение АДФ;
4) высвобождение ионов кальция с поверхности АТФазы, обращенной внутрь пузырьков СР; связывания магния;
5) гидролиз фосфатной связи и отщепление ионов магния;
6) переход молекулы фермента в исходное состояние (центры связывания кальция оказываются опять на поверхности пузырьков СР).
Основным регулятором кальциевых АТФаз цитоплазматической мембраны служит белок - кальмодулин. Дело в том, что цитоплазматическая Са-АТФаза обладает любопытной способностью ингибировать саму себя. Ее С-конец, экспонированный в цитоплазму, загибается и, подобно жалу скорпиона, поражает Са-АТФазу, блокируя центры связывания кальция. Кальмодулин берет на себя функцию защитника: он связывается с участком вблизи С-конца и снимает ингибирование Са-АТФазы, лишая полипептидный хвост способности связываться с активным участком АТФазы.
Существуют два типа Са-АТФаз. Одна ферментная система обеспечивает выброс Са2+ из клетки в межклеточную среду (Са-насос плазматических мембран), другая — аккумуляцию Са2+ из клеточного содержимого во внутриклеточное депо (Са-насос внутриклеточных мембран). Примером первого может служить Са-насос эритроцитов, второго — Са-насос сар-коплазматического ретикулума. Оба они способны создавать более чем 1000-кратный градиент Са2+ на своих мембранах, контролируя в клетке уровень Са2+ — иона, регулирующего многие стороны жизнедеятельности клетки. Са-АТФаза активируется низкими концентрациями Са2+, высокие концентрации Са2+ тормозят ее активность.
Одна из причин нарушения работы Са2+-АТФ-азы - активация перекисного окисления липидов (ПОЛ) мембран. Окислению подвергаются как ацильные остатки жирных кислот в составе фосфолипидов, так и SH-гpyппы в активном центре фермента. Нарушение структуры липидного окружения и структуры активного центра приводит к изменению конформации АТФ-азы, потере сродства к ионам кальция и способности к аутофосфорилированию. АТФ-аза перестаёт выкачивать ионы кальция из цитозоля клетки, повышается концентрация внутриклеточного кальция, Са2+ усиливает мышечное сокращение, возрастает тонус мышечной стенки, что приводит к повышению АД. Не последнюю роль нарушение функционирования Са2+-АТФ-азы играет в развитии атеросклероза, рака, иммунных патологий.
Mg- АТФ-аза -мембранный фемент.
Mg2+- АТФаза обеспечивает высвобождение энергии, что является необходимым элементом практически для всех внутриклеточных энергообразующих и энергопотребляющих процессов различных органов и систем.
Отмечается достоверная взаимосвязь активности Mg2+- АТФазы с активностью Ca2+- АТФазы
При различной мышечной патологии происходит изменение активности Mg2+-АТФазы.
 2015-06-26
2015-06-26 6322
6322








