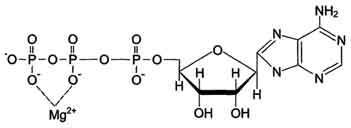
Ионы Mg2+ способны образовывать обратимые соединения с органическими веществами, обеспечивая возможность их участия в разнообразных биохимических реакциях и активируя более чем 300 ферментов. В роли кофактора он принимает участие во многих ферментативных процессах, в частности, в гликолизе, и гидролитическом расщеплении АТФ. Находясь в комплексах с АТФ, Mg2+ обеспечивает высвобождение энергии через активность Mg2+ зависимых АТФ-аз.
Ионы Mg2+ играют важнейшую роль в электролитном балансе и процессах мембранного транспорта, требующего больших энергозатрат. Связываясь с клеточными, митохондриальными и другими мембранами, они регулируют их проницаемость для прочих ионов. Особое значение ионы Mg2+ имеют в поддержании трансмембранного потенциала. Активируя Mg2+ зависимую Na+-K+-АТФ-азу, они определяют работу K+/Na+ насоса. В качестве кофактора пируватдегидрогеназного комплекса он регулирует поступление продуктов гликолиза в цикл Кребса и этим препятствует накоплению лактата. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-ATФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента.
H+-АТФаза плазматической мембраны - основная электрогенная система.
Имеется большое число ферментов, которые катализируют разнообразные биохимические процессы. Среди этих ферментов особое место принадлежит Н+-АТФазе поверхностной мембраны. Данная ферментная система выполняет, казалось бы, весьма непримечательную роль, гидролизуя молекулы АТФ. Но наряду с этим она осуществляет и необычную функцию. Н+-АТФаза использует энергию, освобождающуюся при гидролизе АТФ для того, чтобы переносить через клеточную мембрану ионы водорода. Это обстоятельство позволило рассматривать Н+-АТФазу как активную транспортную систему, то есть своеобразную молекулярную машину.
Особая роль Н+-АТФазы заключается в том, что, выкачивая протоны из клетки наружу, она не только поддерживает рН цитоплазмы близкий к нейтральному (что очень важно для протекания многих ферментативных процессов), но и создает на мембране разность потенциалов.
Н+-АТФаза - это интегральный белок, полипептидная цепь которого десять раз пересекает поверхностную (плазматическую) мембрану. Полагают, что в мембране Н+-АТФаза функционирует в виде олигомера и состоит из двух субъединиц. Хорошо изучены как первичная структура Н+-АТФазы (то есть аминокислотная последовательность ее полипептидной цепи), так и структуры более высоких порядков (вторичная, третичная). В молекуле Н+-АТФазы различают несколько участков (доменов), из которых основные - это домен, связывающий АТФ четырьмя местами связывания, и домен, имеющий отношение к переносу протона, включающий канал. Истинным субстратом Н+-АТФазы является не сама АТФ, а ее комплекс с магнием (Mg-АТФ). В процессе работы Н+-АТФаза подвергается фосфорилированию-дефосфорилированию и обратимо меняет свою конформацию: при этом она переходит из формы Е1 в форму Е2 и обратно. В форме Е1 она связывает протон на внутренней стороне мембраны, а в форме Е2 освобождает его на наружной стороне Для нормального функционирования Н+-АТФазы в мембране необходимо присутствие некоторых фосфолипидов. Оптимум рН этой ферментной системы лежит в слабокислой среде (рН 6,3-6,5).
СУКЦИНАТДЕГИДРОГЕНАЗА
Сукцинатдегидрогеназы всех изученных организмов прочно связаны с внутренней мембраной митохондрий, являясь компонентами электронотранспортной дыхательной цепи.
Активность сукцинатдегидрогеназы часто используют для идентификации внутренней мембраны митохондрий при фракционировании клеток и клеточных органелл.
Сукцинатдегидрогеназа катализирует прямую и обратную реакцию (фумаратредуктазную)-восстановление фумарата до сукцината и переход сукцината в фумарат; доноры электронов -убихинолы, флавинмононуклео-тид и др.
Фермент состоит из 4 субъединиц и содержит в качестве окислительно-восстановительных. групп флавинадениндинуклеотид (ковалентно связанный с самой тяжелой субъединицей) и 3 Fe-S-кластера. Одна из малых субъединиц сукцинатдегидрогеназы содержит гем. Активный центр, связывающий сукцинат, локализован на самой тяжелой субъединице. В специфическом связывании сукцината участвуют остатки аргинина, гистидина и цистеина. Сукцинатдегидрогеназа проявляет оптимум каталитической активность при рН 7,5-8.
 2015-06-26
2015-06-26 2104
2104








