Насьогодні одна із систематизацій шляхів трансдукції сигналів може бути заснована на певних вторинних месенджерах, які беруть участь у сигнальних каскадах:
1) цАМФ опосередковані шляхи
2) цГМФ опосередковані шляхи (незалежні від NO)
3) цГМФ і NO-опосередковані шляхи
4) шляхи, опосередковані іонами Са2+, ДАГ і інозитолтрифосфатом
5) шляхи, опосередковані іншими похідними ліпідів
6) шляхи, опосередковані малими G-білками
7) шляхи без залучення системи вторинних месенджерів
Історично, першим вторинним месенджером було відкрито циклічну АМФ (цАМФ)- Сазерленд (1957) і першим каскадом, який було вивчено, був саме каскад, що активується циклічними нуклеотидами. Зв'язування рецептору із специфічним лігандом приводить до приєднання до цього рецептору так званого G-білка (гуаніннуклеотидзв'язуючого білка). Нагадаємо, що ці G-білки пов'язані з роботою цАМФ-залежної і фосфатидилінозітольної системи трансдукції сигналу (основні ефектори G-білків – аденілатциклаза=АЦ і фосфоліпаза С=ФЛС), виконують функцію трансмітерів, передаючи сигнал від рецептора всередину клітини. Утворений комплекс активує аденілатциклазу, що перетворює АТФ на цАМФ. [Гормон -регульовані АЦ є трансмембранними глікопротеїдами, які активуються системою G-білків, що активно співпрацюють з системою рецепторів (GPCR), пов’язаних з G-білками. Ці рецептори належать до найбільшого класу поверхневих молекул, залучених у трансдукцію сигналу; складаються з 7 α-спіралей-7ТМ. G-білки є гетеротримерами і складаються з субодиниць α, β, γ, причому α- субодиниці є активуючими (αs) і інгібуючими (αi), тобто роботу аденілатциклази по різному регулюють два види білків (Gs та G i). Зв’язування сигнальної молекули з рецептором стимулює структурні перебудови G-білка, що в свою чергу приводить до втрати спорідненості α до ГДФ та заміну її на ГТФ, подальше найчастіше вивільнення α·ГТФ з комплексу з субодиницями β, γ, латеральна дифузія в мембрані до зустрічі з АЦ та активація (інгібування) мембраннозв’язаної АЦ. Завдяки власній ГТФазній активності Gα каталізує розщеплення ГТФ до ГДФ і фосфату, після чого активізуються зворотні описаним вище процеси).
|
|
|
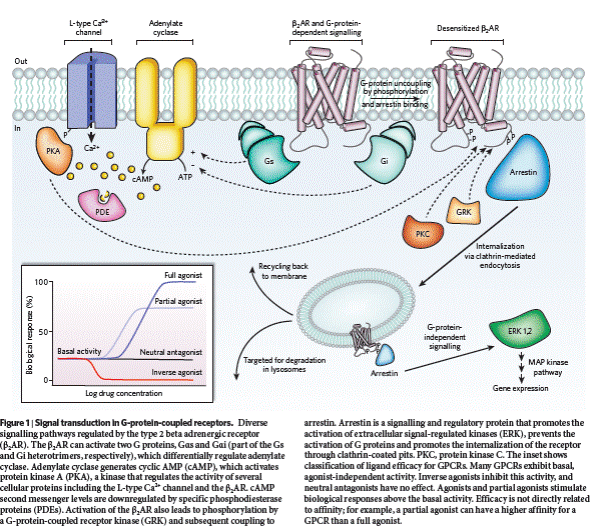
цАМФ активує протеїнкіназу А (ПК-А), яка фосфорилює білки по залишках серину та треоніну і таким чином активує їх. Повернення до неактивованого стану відбувається за допомогою цАМФ-фосфодіестерази, що перетворює цАМФ у 5´-АМФ, і фосфатази, яка дефосфорилює активований білок. Слід відмітити, що в процесах активації значну роль відіграє і дефософорилювання - для повернення системи у початковий стан і здатності її сприймати наступні сигнали. Система цАМФ працює в адренорецепторах, дофамінових, гістамінових рецепторах, рецепторах до аденозину, простагландинів, вазопресину, глюкагону.
|
|
|
Далі було відкрито, що подібним вторинним месенджером є і цГМФ. Він утворюється під дією гуанілатциклази. Цитозольний форма цього ферменту активується монооксuдами NO, CO i OH, які на думку ряду авторів разом з церамідом, фосфатидною кислотою, циклоаденозинмонофосфат-рибозою належать до родини вторинних посередників. цГМФ активує іншу протеїнкіназу - ПК-Г, яка фосфорилює інші, ніж ПК-А білки (теж по залишках серину і треоніну).
До початку 80-х років каскади цАМФ і цГМФ були найбільш вивченими і вважалися за головні. Однак пізніше було з'ясовано, що існують і інші каскади і в імунних клітинах самевони відіграють головну роль у передачі сигналу від антиген-специфічних рецепторів. Головним із цих каскадів виявився поліфосфоінозитидний (вторинні месенджери -Са2+, ІФ3).
Отже на початку 90-х років 20 ст. було показано, що саме Са2+, поліфосфо-інозитидний каскад відіграє провідну роль у передачі сигналу від антиген-специфічних рецепторів у клітинах імунної системи.
Ключовим ферментом цього каскаду є фосфоліпаза С (ФЛ-С), яка активується після зв’язування рецептора із специфічним лігандом. Активація цього ферменту, що міститься на внутрішній стороні плазмолеми, залежить від його ізоформи. Для ФЛ-Сβ характерним трансмітером є G-білок.
Для антиген-специфічних рецепторів імунних клітин є характерною ФЛ-Сγ, яка у клітинах вищих хребетних також поділяється на дві ізоформи Сγ 1 і Сγ 2.
Перша ізоформа експресована у клітинах усіх типів, а друга- тільки в імунокомпетентних. Отже останні мають обидві форми фосфофоліпази Сγ. ФЛ-Сγ в неактивному стані не прикріплена до мембрани, а вільно дифундує у цитозолі. Тому у процесі дифузії молекули ФЛ-Сγ можуть опосередковано зв’язуватись з антиген-специфічним рецептором і бути фосфорильованими по залишкам тирозину специфічними тирозиновими кіназами - виконавцями трансміттерних функцій.
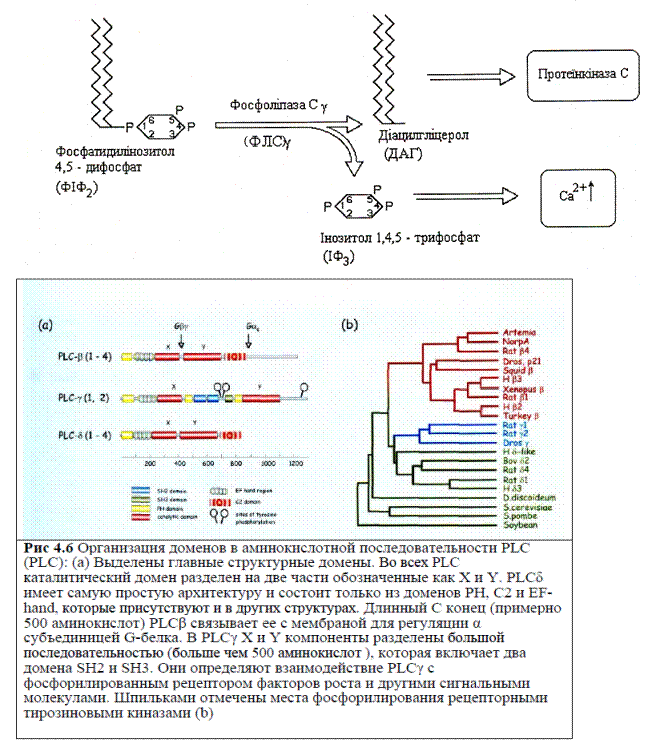
Таким чином на рівні активації сигналінгу з залученням Т- і В- клітинного рецептору одним з механізмів є рекрутування внутрішньоклітинних білків до плазматичної мембрани шляхом тирозин-залежного фосфорилювання власне рецептора, так і скафолдних і адапторних білків (I). Другий механізм – активація мембрано-асоційованих G-білків, які рекрутують сигнальні молекули до мембрани (II). Третій механізм – локальне утворення модифікованих мембранних ліпідів в результаті активації рецепторів (III).
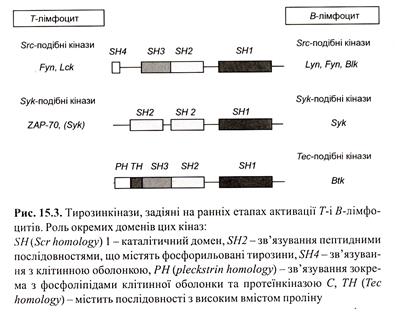
I. Тирозинові кінази, що беруть участь у передачі сиґналу від антигенспецифічного рецептора Т- і В-клітин, поділяють на чотири (п’ять) родини за спільними ознаками будови та гомологією амінокислотних послідовностей. Слід підкреслити, що всі тирозинові кінази, крім каталітичного, мають консервативні домени, які визначають взаємодію кіназ з певними субстратами, а також їх локалізацію в сигнальному комплексі.
Зараз ми розглянемо доменну структуру сигнальних білків, до яких належать тирозинові протеїнкінази, фосфоліпаза Сγ (PL Cγ), фосфоінозитид- 3 кіназа (РІ3К), адапторні білки і т.д.
 |
 2015-07-04
2015-07-04 1342
1342








