В нервно-мышечном синапсе позвоночных из пресинаптического нервного окончания выделяется нейромедиатор - ацетилхолин, а на постсинаптической мембране расположены никотиновые (н) холинорецепторы.
Н-холинорецептор является одним из наиболее хорошо изученных и давно известных рецепторов. Размер и структура н-холинорецепторов были определены при помощи электронной микроскопии, молекулярной биологии, генетики и других методов. Он состоит из пяти субъединиц – двух α, одной β, одной γ и одной δ, образующих кольцо вокруг центральной поры (рис. 29А). Диаметр молекулы в самой широкой ее части составляет 8,5 нм, а длина – 11 нм. Диаметр центральной поры составляет около 0,7 нм. Третичная структура α-субъединицы с 4-мя трансмембранными спиралями представлена на рисунке 29Б. Строение других трех субъединиц весьма сходно со структурой α-субъединицы, с незначительными вариациями нескольких аминокислот.
Для активации н-холинорецептора необходимо присоединение двух молекул ацетилхолина, по одной к каждой α-субъединице. Длительность взаимодействия ацетилхолина с рецепторами зависит от активности ацетилхолинэстеразы – фермента, расположенного в синаптической щели и разрушающего ацетилхолин на уксусную кислоту и холин, и обычно очень короткая. Никотиновые рецепторы бывают двух типов – мышечного и нейронального, причем существует 7 разновидностей нейрональных холинорецепторов.
|
|
|
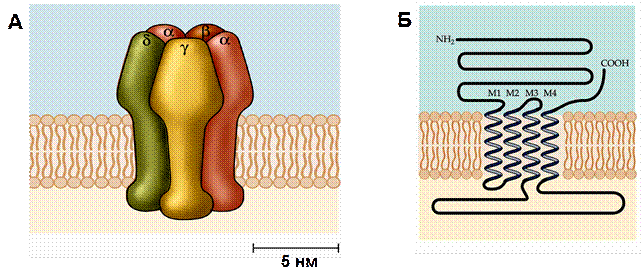
Рис. 29. Структура никотинового холинорецептора
А – н-холинорецептор состоит из пяти субъединиц (2 α, β, γ и δ), расположенных радиально с углом около 720 вокруг центра, что обеспечивает фомирование центральной поры. Б – третичная структура α-субъединицы н-холинорецептора. Аминокислотная последовательность имеет 4 трансмембранных спирали (М1-М4), а оба конца (СООН и NH2) обращены во внеклеточное пространство.
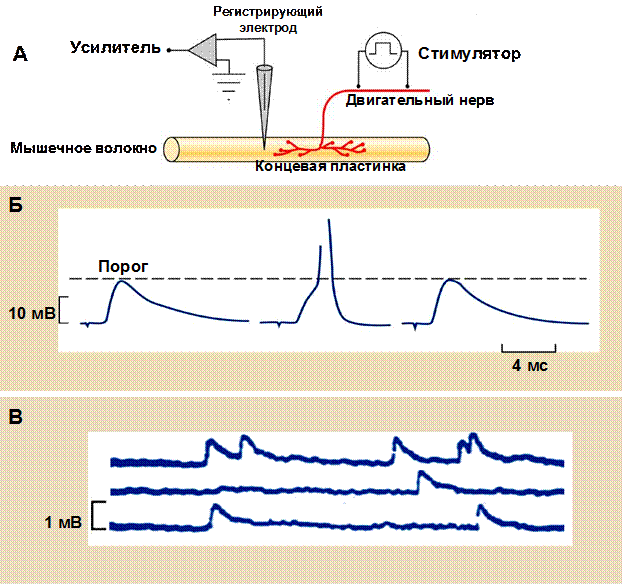
Рис. 30. Регистрация постсинаптических потенциалов в нервно-мышечном синапсе
А – показана принципиальная схема электрофизиологического эксперимента по регистрации потенциалов концевой пластинки. Нервно-мышечный препарат – мышца, выделенная вместе с иннервирующим ее двигательным нервом - помещается в специальную ванночку, наполненную физиологическим раствором. Двигательный нерв стимулируется прямоугольными толчками тока при помощи металлических электродов, подключенных к стимулятору. Для отведения потенциалов концевой пластинки используются регистрирующий (заполненная раствором электролита стеклянная пипетка с острым кончиком, в которую введена хлорсеребряная проволока) и индифферентный электроды, подключенные к усилителю и погруженные в ванночку. Собственно регистрация потенциалов концевой пластинки осуществляется путем введения острого кончика регистрирующего электрода в синаптическую область мышечного волокна. Б – Показана графическая запись потенциалов концевой пластинки на фоне блокирования н-холинорецепеторов ядом кураре. Концентрация кураре подобрана таким образом, что амплитуда потенциалов концевой пластинки иногда достигает порога генерации ПД (второй сигнал), а иногда нет (первый и третий сигналы). В – в отсутствии стимуляции двигательного нерва возникают миниатюрные ПКП, амплитуда которых значительно меньше.
|
|
|
Итак, выделение ацетилхолина в нервно-мышечном синапсе вызывает активацию н-холинорецепторов и возникновение потенциала концевой пластинки (ПКП). ПКП впервые были зарегистрированы при помощи стеклянных микроэлектродов в 50-х годах 20-го века (рис. 30, последняя страница обложки). Это было возможно при использовании яда кураре, который селективно блокирует холинорецепторы, уменьшает амплитуду ПКП ниже порогового уровня и тем самым предотвращает генерацию потенциала действия мышечного волокна. Помимо ПКП, вызванных потенциалом действия, можно зарегистрировать миниатюрные ПКП, возникающие спонтанно в отсутствии стимуляции (рис. 30 В). В этом случае использовать кураре не нужно, поскольку амплитуда МПКП и так очень мала. Если регистрирующий микроэлектрод отдалять от области концевой пластинки, то амплитуда ПКП уменьшается, а их длительность увеличивается, что свидетельствует о том, что ПКП появляется лишь в области синапса.
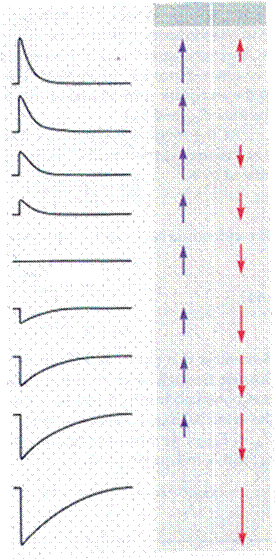
Ионная природа ПКП была установлена позднее, в 60-х годах. С использованием метода фиксации мембранного потенциала (Рис. 20А) было выявлено, что величина и направление ионных токов, лежащих в основе ПКП, зависят от потенциала на мембране (рис. 31). При нормальном потенциале мембраны скелетного мышечного волокна (около -90 мВ) ток концевой пластинки (ТКП) имеет входящее направление. Если снижать мембранный потенциал, то при определенном его значении амплитуда ТКП становится равной нулю. Эта величина потенциала на мембране получила название потенциала реверсии. В нервно-мышечном синапсе лягушки потенциал реверсии составляет около 0 мВ (Рис. 31). Если производить дальнейшее смещение мембранного потенциала в сторону положительных значений, то ТКП приобретает выходящее направление.
Почему важно знать потенциал реверсии? Потенциал реверсии ТКП дает информацию об ионных токах, которые протекают через каналы рецептора. Например, если бы каналы были проницаемы только для натрия, потенциал
 К+ ток Na+ ток
К+ ток Na+ ток
+75 мВ
+55 мВ
+40 мВ
+20 мВ
-20 мВ
-50 мВ
-90 мВ
-100 мВ
Рис.31. Зависимость амплитуды и направления суммарного тока концевой пластинки от мембранного потенциала
Показаны суммарные токи концевой пластинки, зарегистрированные при фиксации мембранного потенциала на различных уровнях, и движущие силы для натрия и калия (вверх – из клетки, вниз – в клетку) при каждом значении потенциала. При отрицательных значениях мембранного потенциала электрохимическая движущая сила для ионов натрия, направленная внутрь, гораздо больше, чем движущая сила для ионов калия, направленная наружу, поэтому суммарный ТКП имеет входящее направление (на рисунке – вниз). При потенциале мембраны 0 мВ движущие силы для натрия и калия становятся равными, поэтому суммарный ТКП принимает нулевое значение. При положительных значениях потенциала электрохимическая движущая сила для ионов калия становится больше, чем движущая сила для ионов натрия, поэтому ТКП приобретает выходящее направление.
реверсии соответствовал бы натриевому равновесному потенциалу (около +50 мВ). Для калия и хлора потенциал реверсии составляет около -90 мВ, а для кальция +120 мВ. Как видно, ни один из ионов не имеет потенциал реверсии в районе 0 мВ (рис. 31).
|
|
|
Оказалось, что канал н-холинорецептора проницаем сразу для нескольких ионов. Изменение наружной концентрации натрия или калия сильно влияло на величину потенциала реверсии, изменение концентрации кальция имело гораздо меньший эффект, а варьирование концентрации хлора вообще не вызывало изменений. На основании этих данных был сделан вывод о том, что н-холинорецепторы пропускают только катионы. В этом случае при потенциале реверсии хотя суммарный ТКП и равен нулю, это не означает, что через постсинаптическую мембрану не текут токи. На самом деле будет течь два тока одинаковой величины и противоположного направления – входящий натриевый и выходящий калиевый. При смещении потенциала в ту или другую сторону от значения реверсии будет наблюдаться преобладание натриевого либо калиевого тока (рис. 31).
В. Постсинаптические потенциалы в межнейрональных синапсах
Потенциал концевой пластинки скелетной мышцы является возбуждающим, поскольку он деполяризует мембрану, и при достижении критического уровня деполяризации приводит к возникновению потенциала действия. Аналогичные потенциалы возникают в межнейрональных синапсах и носят название возбуждающие постсинаптические потенциалы (ВПСП). В мозге они возникают при активации рецепторов к глутамату (NMDA и AMPA), аспартату и некоторым другим медиатором. В общем виде, возбуждающим эффектом будут обладать те ионотропные рецепторы, канальная пора которых проницаема для натрия и/или кальция.
Установлено, что помимо возбуждающих, в центральной нервной системе существуют и тормозные постсинаптические потенциалы (ТПСП). Они обладают противоположными свойствами, то есть гиперполяризуют постсинаптическую мембрану, понижают возбудимость клетки и препятствуют генерации потенциала действия. Процесс генерации тормозных потенциалов получил название постсинаптического торможения. В центральных синапсах тормозные постсинаптические потенциалы возникают при активации глициновых рецепторов и рецепторов к гамма-аминомасляной кислоте (ГАМК), пропускающих внутрь клетки ионы хлора либо выпускающих из клетки ионы калия. Большую роль в расшифровке механизмов торможения в ЦНС сыграли исследования, выполненные выдающимся физиологом Сэром Джоном Экклсом, о котором мы уже упоминали ранее (рис. 26).
|
|
|
Далее мы рассмотрим постсинаптические потенциалы, возникающие в нейронах при возбуждении ионотропных рецепторов к различным нейромедиаторам.
 2015-07-04
2015-07-04 2486
2486








