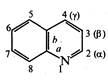
 Хінолін (бензо[b]піридин) являє собою конденсовану гетероциклічну систему, що складається з піридинового та бензольного кілець.
Хінолін (бензо[b]піридин) являє собою конденсовану гетероциклічну систему, що складається з піридинового та бензольного кілець.
Нумерацію атомів у молекулі хіноліну починають з гетероатома, атоми вуглецю в піридин новому циклі позначають літерами α, β та γ.
А. Способи добування
Хінолін вперше було виділено у 1834 р. німецьким хіміком-органіком Ф.Ф.Рунге з продуктів перегонки кам'яновугільної смоли. Кам'яновугільну смолу і тепер використовують для добування хіноліну та деяких його метилпохідних.
Зі способів синтезу хіноліну та його похідних найважливішими є синтез Скраупа та синтез Дебнера-Міллера.
Синтез Скраупа. Реакція ґрунтується на взаємодії аніліну та його заміщених в бензольному ядрі похідних, що мають вільне орто- положення, з гліцерином, концентрованою сірчаною кислотою та окисником при нагріванні. Як окисник частіше використовують нітросполуку, котра відповідає вихідному аміну.
Для добування хіноліну за методом Скраупа нагрівають анілін з гліцерином і концентрованою H2SО4 у присутності окисника нітробензолу:
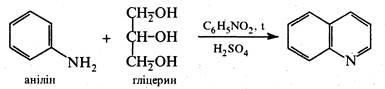
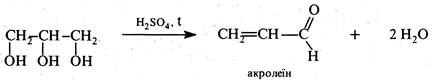
Механізм реакції включає три послідовні стадії. На першій стадії гліцерин під дією концентрованої сірчаної кислоти піддається дегідратації з утворенням акролеїну.
На другій стадії акролеїн, що утворився, вступає в реакцію з аніліном:
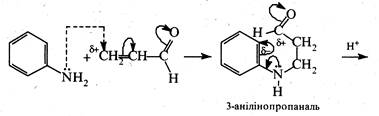
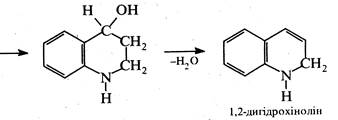
Спочатку відбувається нуклеофільне приєднання аніліну за місцем розриву активованого подвійного вуглець-вуглецевого зв'язку молекули акролеїну. Далі 3-анілінопропаналь, який утворився, в кислому середовищі піддається циклізації, перетворюючись при цьому на 1,2-дигідрохінолін. Замикання циклу зумовлене електрофільною атакою карбонільною групою орто -положення бензольного кільця.
На третій стадії реакції 1,2-дигідрохінолін окиснюється нітробензолом у хінолін.
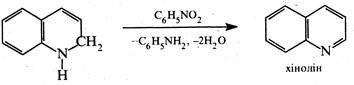
У процесі окиснення нітробензол кількісно відновлюється до аніліну, котрий знову вступає в реакцію за викладеним механізмом.
При використанні в синтезі Скраупа замість аніліну його заміщених в бензольному ядрі з вільним орто -положенням утворюються похідні хіноліну, що містять замісники в бензольному кільці. Реакція відкрита в 1880 р. австрійським хіміком-органіком З.Х.Скраупом.
Синтез Дебнера-Міллера. Цей спосіб є модифікацією синтезу Скраупа та використовується для добування похідних хіноліну з алкільними замісниками в піридиновому циклі.
Синтез Дебнера-Міллера полягає в нагріванні первинного ароматичного аміну з альдегідом (здатним до кротонової конденсації) в присутності хлориду цинку (II), хлороводневої або інших кислот. Механізм цієї реакції подібний до механізму реакції Скраупа. На першій стадії проходить кротонова конденсація двох молекул альдегіду з утворенням α,β-ненасиченого альдегіду, котрий взаємодіє далі з ароматичним аміном, як і в синтезі Скраупа. Роль окисника виконують азометани С6Н5—N=CH—R, які утворюються в процесі реакції.
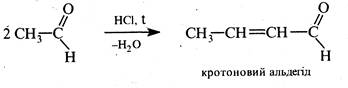
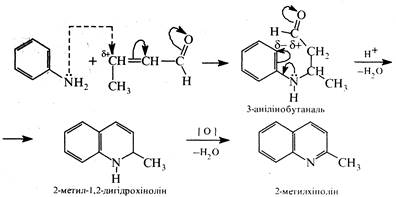
Реакцію було відкрито в 1881 р. О.Дебнером і В.Міллером.
Б. Фізичні властивості
Хінолін — безбарвна рідина (т. кип. 237 °С), добре змішується з водою, етанолом, діетиловим ефіром та іншими органічними розчинниками, переганяється з водяною парою.
Хінолін є ароматичною сполукою. Його молекула має плоску будову та містить замкнену спряжену π-електронну систему з 10π-електронів, яка задовольняє правилу Хюккеля.
За хімічними властивостями хінолін нагадує піридин. Йому характерні реакції за участю гетероатома, реакції електрофільного та нуклеофільного заміщення атомів водню хінолінового ядра, а також реакції окиснення та відновлення.
1. Реакції по гетероатому. Наявність у молекулі хіноліну атома азоту піридинового типу надає сполуці основних властивостей. Як основа хінолін дещо слабший від піридину (рКВН+ хіноліну в Н2О становить 4,94; рКВН+ піридину 5,25).
За участю гетероатома хінолін, аналогічно піридину, утворює солі з сильними кислотами, алкіл- і ацилгалогенідами:
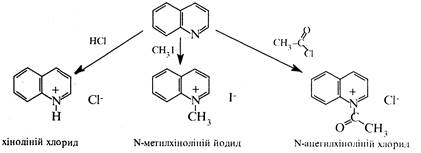
2. Реакції електрофільного та нуклеофільного заміщення. Через електроноакцепторний вплив гетероатома в молекулі хіноліну електронна густина зменшена у порівнянні до його бензоаналогу нафталіну та розподілена нерівномірно: в піридиновому кільці вона нижче, ніж у бензольному. Тому при дії електрофільними реагентами заміщення переважно іде по бензольному кільцю, а нуклеофільними по піридиновому.
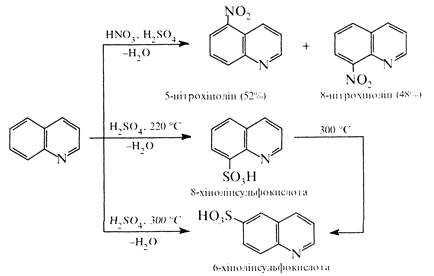
Реакції електрофільного заміщення в молекулі хіноліну проходять здебільшого в положеннях 5 і 8. Так, при нітруванні нітруючою сумішшю утворюється суміш 5- і 8-нітрохінолінів. сульфування концентрованою сірчаною кислотою при 220 °С приводить до утворення 8-хінолінсульфокислоти, а при 300 °С термодинамічно вигіднішої 6-хінолінсульфокислоти (за цих умов 5- і 8-ізомери перегруповуються в 6-ізомер).
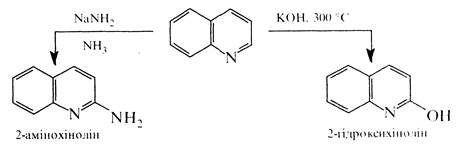
В реакції нуклеофільного заміщення хінолін вступає легше, ніж піридин. При цьому, як і в кільці піридину, нуклеофільній атаці піддається переважно положення 2. Так, при дії на хінолін амідом натрію в середовищі рідкого аміаку утворюється 2-амінохінолін згідроксидом калію при 280-300 °С хінолін утворює 2-гідроксихінолін:
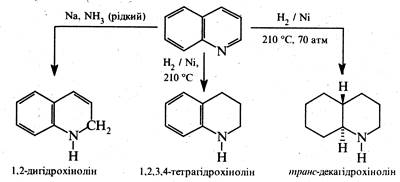
3. Реакції відновлення і окислення. Відновлення хіноліну проходить передусім у піридиновому ядрі. При дії більшості відновників з високим виходом утворюється 1,2-дигідрохінолін, у присутності нікелю Ренея хінолін відновлюється воднем до 1,2,3,4-тетрагідрохіноліну Каталітичне гідрування за жорстких умов торкається також бензольного кільця.
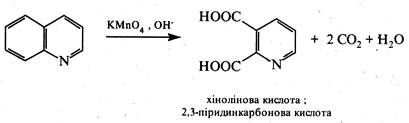
Окиснення хіноліну та його гомологів з замісниками в бензольному ядрі дією перманганатом калію в лужному середовищі супроводжується розщепленням бензольного кільця та приводить до утворення 2,3-піридиндикарбонової кислоти (хінолінова кислота).
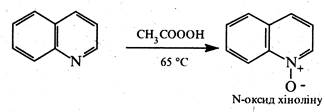
Аналогічно піридину, в присутності пероксикислот хінолін окиснюється по гетероатому з утворенням N-оксиду:
Г. Найважливіші похідні хіноліну
Хінолінове ядро є структурним фрагментом молекул деяких алкалоїдів (див. розд. 4.5) та лікарських засобів.
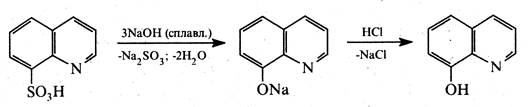
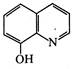 8-Гідроксихінолін. Це безбарвна кристалічна речовина (т. пл. 75-76 °С) з характерним запахом, малорозчинна у воді, розчинна у хлороформі, діетиловому ефірі та бензолі. 8-Гідроксихінолін добувають нагріванням орто- амінофенолу з гліцерином і сірчаною кислотою в присутності орто -нітрофенолу (синтез Скраупа) або сплавленням 8-хінолінсульфокислоти з лугами.
8-Гідроксихінолін. Це безбарвна кристалічна речовина (т. пл. 75-76 °С) з характерним запахом, малорозчинна у воді, розчинна у хлороформі, діетиловому ефірі та бензолі. 8-Гідроксихінолін добувають нагріванням орто- амінофенолу з гліцерином і сірчаною кислотою в присутності орто -нітрофенолу (синтез Скраупа) або сплавленням 8-хінолінсульфокислоти з лугами.
З іонами багатьох металів (Mg2+, Al3+, Zn2+, Мn2+, Со2+, Ni2+,Сu2+, Fe2+, Fe3+ та ін.) 8-гідроксихінолін утворює малорозчинні у воді комплекси (хелати).
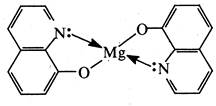
На цій властивості ґрунтується застосування 8-гідроксихіноліну як аналітичного реагенту.
Ряд похідних 8-гідроксихіноліну використовуються в медичній практиці як протимікробні засоби. До них відносяться такі лікарські препарати, як хінозол, нітроксолін (5-НОК) і ентеросептол:
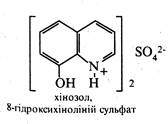
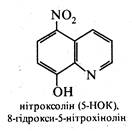
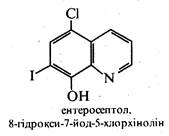
Вважають, що їх бактерицидна дія викликана зв'язуванням іонів Co2+, необхідних для життєдіяльності мікроорганізмів.
 2015-07-14
2015-07-14 2382
2382








