В гомогенных системах реакция протекает во всем объеме реактора. Скорость реакции в таких процессах можно интенсифицировать изменением состава реакционной среды, температуры и давления.
Влияние состава реакционной среды зависит от величины концентрации реагентов и их физико-химических свойств.
Согласно закону действующих масс, уравнение скорости для гомогенной реакции (5.29) можно записать в виде формулы (5.30):
a A + b B ® d D, (5.29)
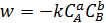 , (5.30)
, (5.30)
где w – скорость химической реакции;
СА, СВ – молярные концентрации реагентов А и В;
a, b – порядок реакции по реагентам А и В;
k – константа скорости реакции.
Таким образом, скорость реакции пропорциональна произведению концентраций реагентов, взятых в степенях, равных порядку реакции, на основе чего следуют выводы:
– чем выше значение концентраций, тем больше скорость реакции;
– скорость реакции в большей степени зависит от реагента, входящего в уравнение скорости с большей степенью;
– если одновременно протекают реакции с разными порядками, то изменение концентрации значительнее скажется на скорости реакции с более высоким порядком.
|
|
|
Данные закономерности лежат в основе технологического приема – избытка одного из реагентов. При этом выгоднее в избытке брать реагент, входящий в уравнение реакции с более высоким стехиометрическим коэффициентом. Но существует ряд причин, по которым во многих газофазных и жидкофазных процессах реагенты разбавляют растворителем, то есть понижая их концентрацию. Этому есть несколько причин:
– возможность перегрева реакционной массы при проведении сильно экзотермической реакции с большой скоростью;
– использование низких концентраций – требование селективного течения сложных реакций, если побочная реакция более высокого порядка;
– улучшение условий протекания сопровождающих реакцию физических процессов, так как разбавление позволяет понизить вязкость, облегчить равномерное перемешивание реакционной массы и ее транспорт, обеспечить более интенсивный и равномерный теплообмен.
Влияние температуры на скорость реакции описывается уравнением Аррениуса (5.31):
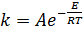 , (5.31)
, (5.31)
где k – константа скорости;
А – предэкспоненциальный множитель;
Е – энергия активации, кДж/моль;
R – газовая постоянная, кДж/моль;
Т – температура, К.
Из уравнения следует, что поскольку температура входит в показатель степени, то она оказывает очень большое влияние на скорость реакции. По этой же причине существенно влияние на скорость и значения энергии активации, но с другим знаком.
Применяемый в химической технологии диапазон давлений очень широк. Имеется несколько причин, по которым повышенное давление, несмотря на высокие энергозатраты, широко применяется в химической технологии:
|
|
|
– существенно повышает скорость газофазных процессов, так как в этом случае резко повышается концентрация реагентов;
– влияет на положение химического равновесия для обратимых реакций, при этом повышение давления смещает равновесие в сторону прямой реакции, если процесс протекает с уменьшением объема;
– повышает температуры кипения и плавления. Этот эффект используется для проведения процессов в жидкой фазе для веществ, которые при стандартном давлении находятся в газообразном состоянии;
– во многих случаях позволяет снизить температуру синтеза, что важно в системах с низкой термостабильностью реагентов или продуктов процесса.
 2015-08-21
2015-08-21 2967
2967








