К обратимым относят реакции, протекающие одновременно в прямом и обратном направлениях.
В обратимой реакции (5.36) в соответствии с законом действующих масс, скорости прямой и обратной реакций можно записать в виде выражений (5.37, 5.38):
a A + b B ↔ d D, (5.36)
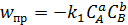 , (5.37)
, (5.37)
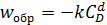 , (5.38)
, (5.38)
где k 1, k 2 – константы скорости прямой и обратной реакций,
a, b, d – стехиометрические коэффициенты (порядки реакции) при участниках процесса A, B, D.
Суммарная скорость обратимой реакции равна разности скоростей прямой и обратной реакций (5.39):
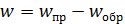 . (5.39)
. (5.39)
В момент равновесия скорости прямой и обратной реакции равны, на основании чего можно записать выражение (5.40):
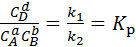 , (5.40)
, (5.40)
где K p – константа равновесия.
Степень превращения, при которой устанавливается равновесие, называют равновесной. В производственных условиях систему не доводят до состояния равновесия, так как в этом состоянии производительность реактора равна нулю. Реактор работает в режиме, удаленном в большей или меньшей степени от состояния равновесия.
|
|
|
Существуют реакции с легко смещаемым равновесием и с неблагоприятным положением равновесия, для которых приемлемая степень конверсии может составлять 30 % и даже меньше.
Смещение равновесия при изменении давления, температуры, концентрации подчиняется принципу Ле-Шателье: внешнее воздействие на систему с установившимся равновесием смещает его в сторону уменьшения этого воздействия.
В качестве примера действия принципа Ле-Шателье рассмотрим реакцию синтеза аммиака (5.41):
3Н2 + N2 «2NH3 + 89 кДж. (5.41)
Эта реакция – простая обратимая, экзотермическая, протекающая с уменьшением объема. Увеличение концентрации одного из реагентов приведет к возрастанию скорости прямой реакции, то есть в сторону образования целевого продукта. В этом случае движущей силой процесса является величина внешнего воздействия.
Такой же эффект можно получить при увеличении давления в системе. Действительно, повышая давление, мы увеличиваем концентрацию всех участников процесса, но увеличение концентрации реагентов будет более значительным, так как число молей исходных веществ больше, чем продуктов реакции. Движущей силой этого процесса является разность объемов конечных и исходных продуктов. Поэтому, в случае равенства объемов конечных и исходных продуктов, сместить равновесие путем изменения давления в системе невозможно.
Влияние изменения температуры на смещение равновесия в данной реакции таково. Поскольку реакция экзотермическая, то сместить равновесие в направлении образования аммиака возможно путем понижения температуры процесса. Движущей силой в этом случае является абсолютная величина такого изменения температуры.
|
|
|
Принцип Ле-Шателье позволяет качественно оценить влияние основных параметров процесса на направление протекания обратимой химической реакции. Количественную оценку на смещение равновесия при изменении температуры или саму возможность протекания данной реакции при постоянном давлении (а именно при постоянном давлении в промышленных химико-технологических процессах, как правило, ведут химические реакции) можно, если известны знак и величина изменения в этом процессе свободной энергии Гиббса (5.42):
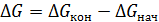 , (5.42)
, (5.42)
где D G нач и D G кон – значения свободной энергии Гиббса реагентов и продуктов процесса соответственно.
Отрицательное значение этой разности означает принципиальную возможность протекания реакции в прямом направлении. Чем больше абсолютная величина этой разности, тем больше движущая сила процесса.
Как известно, изменение энергии Гиббса можно записать в виде (5.43):
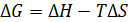 , (5.43)
, (5.43)
где D H – изменение энтальпии (5.44):
D H = H кон – H нач, (5.44)
D S – изменение энтропии (5.45):
D S = S кон – S нач, (5.45)
где H нач, H кон, S нач, S кон – состояния системы, отвечающие начальным и конечным значениям энтальпии и энтропии соответственно.
В соответствии с этим уравнением значение и знак D G определяется значениями D H, D S и T.
Согласно первому закону термодинамики (5.46):
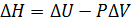 , (5.46)
, (5.46)
где D U – изменение внутренней энергии,
D V – изменение объема при постоянном давлении.
В рассматриваемых условиях D H равна по абсолютной величине, но противоположна по знаку тепловому эффекту реакции Q (Q = – D H).
Изменение энтропии в первом приближении можно оценить, если учесть, что ее можно рассматривать как меру беспорядка системы. Процессы, протекающие с его возрастанием (расширение газа, растворение, испарение, плавление, реакции разложения), то есть с увеличением объема, характеризуются возрастанием энтропии. Процессам, протекающим с уменьшением беспорядка (конденсация, кристаллизация, реакции присоединения, комплексообразования), соответствует уменьшение энтропии.
При выборе оптимальных параметров ведения технологического процесса в случае обратимых реакций, кроме термодинамических закономерностей следует учитывать и особенности процессов, связанных с их кинетикой. Характер влияния температуры на скорость и положение равновесия для обратимых экзо- и эндотермических реакций различен.
Для обратимой экзотермической реакции при малых степенях превращения, когда концентрация исходных продуктов в реакционной массе достаточно велика, а концентрация продуктов реакции мала, обратимая реакция протекает, как необратимая. Поэтому с повышением температуры ее скорость возрастает. По мере увеличения концентрации конечных продуктов и снижения концентрации исходных продуктов, разность скоростей между прямой и обратной реакциями сокращается, и в момент, когда скорости сравняются, наступает равновесие. При этом технологический процесс прекращается. Чтобы этого не происходило, в непрерывных химико-технологических процессах при стационарном режиме осуществляется непрерывная подача свежего сырья и непрерывный вывод продуктов процесса.
В обратимой эндотермической реакции с увеличением температуры скорость прямой реакции возрастает быстрее, чем обратной. При этом возрастает и разность скоростей между прямой и обратной реакциями. На основе изложенного можно обосновать выбор температурного режима химико-технологического процесса для обратимых реакций.
1. Поскольку в случае обратимой эндотермической реакции повышение температуры положительно влияет на оба критерия оптимизации (на скорость и смещение равновесия), такую реакцию лучше проводить при постоянной повышенной температуре.
|
|
|
2. Неоднозначное влияние температуры на критерии оптимизации обратимой экзотермической реакции требует использования режима понижающейся температуры: начинают процесс при более высокой температуре, а затем ее снижают по линии оптимальных температур. Такой прием применим для периодических процессов. В непрерывных процессах поддерживают постоянную температуру, так как явление накопления конечных продуктов и невозобновляемый расход исходного сырья отсутствуют.
Контрольные вопросы
1. Объясните понятие «химико-технологический процесс».
2. Дайте определение понятию «технологический режим». Какие параметры его определяют?
3. Представьте классификацию реакций, определяющих основу ХТП.
4. Напишите уравнение скорости для необратимых и обратимых реакций, для параллельных и последовательных реакций. Какую роль в данных случаях играют энергия активации, порядок реакции и константа скорости?
5. Что такое дифференциальная селективность и для характеристики каких процессов её используют? Как влияет порядок реакции на дифференциальную селективность?
6. Напишите уравнение Аррениуса. Объясните на основе этого уравнения влияние температуры и энергии активации на скорость химических процессов.
7. Объясните влияние давления на скорость гомогенных процессов. Какие давления по абсолютной величине применяют в химической технологии? Приведите примеры.
8. Какие способы используют в промышленности для гомогенизации систем?
9. Что такое ассоциация, полимеризация, крекинг, пиролиз? Где применяются данные процессы?
10. Рассмотрите классификацию реакций по молекулярности. Приведите примеры.
11. Рассмотрите гомогенные процессы, протекающие в жидкой фазе.
12. Рассмотрите гомогенные процессы, протекающие в газовой фазе.
13. Приведите классификацию гетерогенных систем. Дайте примеры.
14. Назовите элементарные стадии гетерогенных процессов.
15. Дайте определение лимитирующей стадии процесса. В каких областях может протекать гетерогенная реакция?
|
|
|
16. От каких факторов зависит скорость гетерогенной реакции, протекающей в диффузионной области? Дайте соответствующее уравнение этой зависимости.
17. Что такое движущая сила процесса массопередачи? Как она влияет на скорость гетерогенных процессов? Как можно повысить градиент концентраций?
18. Дайте определение понятию «химическое равновесие». Как его можно нарушить? Принцип Ле-Шателье.
19. Напишите уравнение Гиббса. На его основе объясните принципиальную возможность протекания химической реакции и величину движущей силы процесса.
 2015-08-21
2015-08-21 876
876








