Хроматометрией называют метод объемного анализа, основанный на использовании в качестве титранта раствора дихромата калия K2Cr2O7 или (реже) хромата калия K2CrO4.
Обычно титрование проводят в кислой среде (сернокислой, солянокислой или фосфорнокислой средах). Дихромат калия в кислой среде является довольно сильным окислителем.
Cr2О72- + 6 e + 14H+ ® 2Cr3+ + 7H2O, 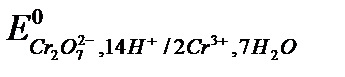 = +1,31 В
= +1,31 В
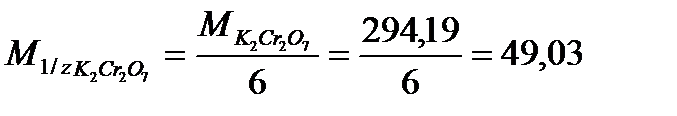 г/моль.
г/моль.
Соединения Cr (VI) обладают большей окислительной способностью, чем элементарный йод 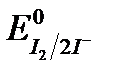 = + 0,54 В, но меньшей, чем перманганат-ион
= + 0,54 В, но меньшей, чем перманганат-ион 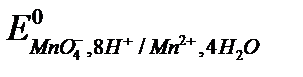 = +1,51 В.
= +1,51 В.
Продажный химически чистый дихромат калия можно применять для приготовления первичных стандартов, после перекристаллизации
и высушивания при 105–110°С. Наиболее часто дихромат калия применяют в виде раствора с молярной концентрацией эквивалента 0,1000 моль/дм3, приготовленного из точной навески при растворении в точном объеме воды.
Хотя растворы дихромата калия окрашены в оранжевый цвет, интенсивность окраски недостаточна для определения конечной точки титрования. В дихроматометрическом титровании применяют
ОВ – индикаторы: дифениламин (с переходом окраски от бесцветной до темно-фиолетовой), дифениламиносульфокислоту (с переходом окраски от зеленой до фиолетовой), фенилантраниловую кислоту (с переходом окраски от бесцветной до красно-фиолетовой). Конечную точку титрования (точку эквивалентности) можно зафиксировать инструментальными методами (потенциометрическое титрование, кондуктометрическое титрование и др.).
|
|
|
Дихромат калия способен окислять многие неорганические и органические вещества: Fe (II), W (III), Mo (V), Ti (III) спирты, гидрохинон, глицерин, аскорбиновую кислоту, тиомочевину и др.
Дихромат калия является первичным стандартом для многих окислительно-восстановительных методов:
· для йодометрии (см. лабораторную работу № 5);
· при титровании солью Мора.
 2015-08-13
2015-08-13 2028
2028








