СПИРТЫ
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу –ОН. По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные и т. д.
Различают первичные, вторичные, третичные одноатомные спирты (изомерия положения гидроксильных групп). Для спиртов существует и структурная изомерия.
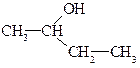 2-бутанол; вторичный бутиловый спирт
2-бутанол; вторичный бутиловый спирт
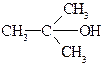 2-метил-2-пропанол; третичный бутиловый спирт
2-метил-2-пропанол; третичный бутиловый спирт
По международной (систематической) номенклатуре в названии спирты имеют окончание «ол» – метанол, этанол, однако низшим спиртам дают и тривиальные названия (винный спирт).
Представителями многоатомных спиртов являются этиленгликоль, глицерин.
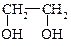
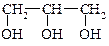
этиленгликоль глицерин
1,2-этандиол 1,2,3-пропантриол
Спирты могут быть предельными (СН3–СН2ОН, этиловый спирт) и непредельными (СН2=СН–СН2–ОН, аллиловый спирт). Ароматические спирты в своем составе имеют бензольное кольцо и боковую цепь.
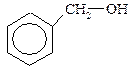
бензиловый спирт
Получают спирты гидролизом галогенопроизводных, присоединением воды к алкенам, восстановлением альдегидов и кетонов, спиртовым брожением глюкозы, полученной гидролизом крахмала и целлюлозы или синтезом из смеси газов СО + Н2.
|
|
|
Физические свойства. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твёрдые вещества. Метанол, этанол и пропанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает.
Многоатомные спирты – этиленгликоль и глицерин – хорошо растворимые в воде жидкости.
1. Взаимодействие спиртов со щелочными металлами (образование алкоголятов).
2СН3–СН2–ОН + 2Na  2СН3–СН2–ONa + H2↑
2СН3–СН2–ONa + H2↑
этилат натрия
2. Образование простых эфиров (межмолекулярная дегидратация спиртов).
2СН3–СН2–ОН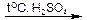 С2H5–O–C2Н5 + Н2О
С2H5–O–C2Н5 + Н2О
этанол диэтиловый эфир
3. Образование сложных эфиров (реакция этерификации).
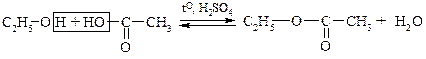
этанол уксусная кислота уксусно-этиловый эфир
(этилацетат)
4. Окисление спиртов:
а) Мягкое окисление.
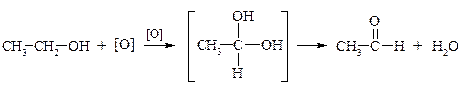 Первичные спирты окисляются в альдегиды, а вторичные – в кетоны.
Первичные спирты окисляются в альдегиды, а вторичные – в кетоны.
этанол уксусный альдегид
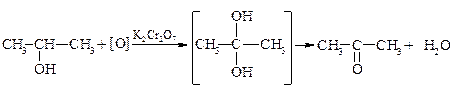
2-пропанол ацетон
б) Жесткое окисление.
горение
СН3–СН2–ОН + 3О2 2СО2 + ЗН2О
2СО2 + ЗН2О
этанол
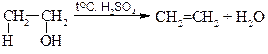 5. Внутримолекулярная дегидратация спиртов (образование ал-кенов).
5. Внутримолекулярная дегидратация спиртов (образование ал-кенов).
этилен
Многоатомные спирты со щелочными металлами образуют полные и неполные гликоляты, с минеральными и органическими кислотами – полные и неполные эфиры.
Процесс окисления гликолей идет ступенчато:
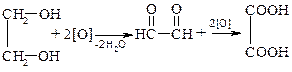
глиоксаль
этиленгликоль щавелевая кислота
Глицерин – представитель трёхатомных спиртов, получают его из жиров или синтетически из пропилена или ацетилена.
|
|
|
Химические свойства глицерина близки к свойствам гликолей. Взаимодействие глицерина с неорганическими и органическими кислотами:
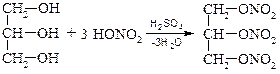
нитроглицерин
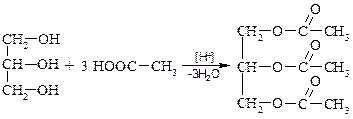
триацетат глицерина
Глицерин подвергается дегидратации с образованием акролеина.
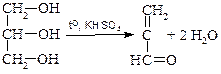
акролеин
Качественной реакцией на многоатомные спирты, с помощью |которой их отличают от одноатомных, является реакция с Cu(ОН)2:
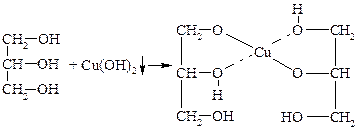
глицерат меди
Глицерат меди хорошо растворяется в воде и имеет ярко-синий цвет.
Многоатомные (сахарные) спирты, ксилит, сорбит, маннит, получают восстановлением ксилозы, глюкозы, маннозы.
Ксилит образуется при восстановлении ксилозы, которую получают из отрубей, шелухи подсолнечника:
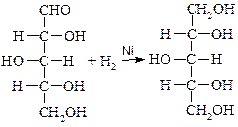
D-ксилоза D-ксилит
Сорбит получают восстановлением глюкозы:
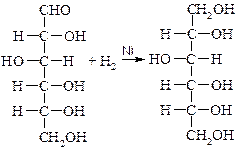
D-глюкоза D-сорбит
Сорбит является исходным веществом для получения аскорбиновой кислоты.
 2014-01-31
2014-01-31 885
885







