Антрацен и фенантрен трициклические конденсированные ароматические углеводороды. Антрацен относится к линеарным, фенантрен – к ангулярным полициклам.
Энергия делокализации антрацена – 84 ккал/моль (351,7 кДж/моль), фенантрена – 92 ккал/моль (385,1 кДж/моль).
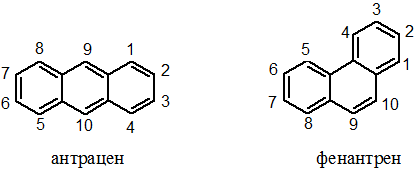
Оба соединения не столь ароматичны как бензол. Ароматичность фенантрена сравнима с нафталином, антрацен менее ароматичен, чем нафталин. Они легко вступают в реакции окисления и восстановления с частичным нарушением ароматической системы. Все реакции (присоединения и замещения) идут в основном по положениям 9 и 10.
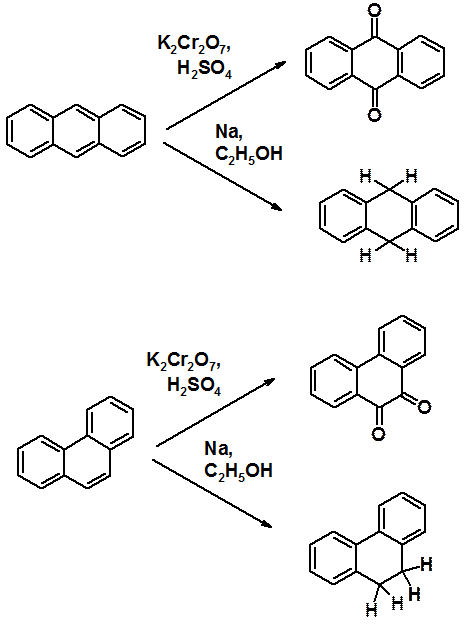
Легко объяснить протекание реакции именно по положениям 9 и 10 трициклических систем. Как видно из схемы, в результате превращений образуются молекулы, имеющие по два изолированных бензольных цикла. Их энергию сопряжения несложно рассчитать: 36 х 2 = 72 ккал/моль. Если предположить возможность протекания восстановления или окисления в боковое кольцо, то в результате образуется бициклическая конденсированная ароматическая система, т.е. нафталин. Его энергия сопряжения 64 ккал/моль, что меньше, чем в рассмотренном выше варианте.
В антрацене реакции бромирования и нитрования протекают через устойчивый продукт присоединения, который ароматизуется только при нагревании.
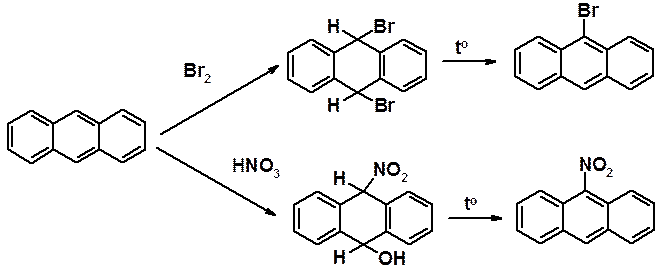
Сульфирование в мягких условиях приводит к 50% смеси 1- и 2-сульфокислот. При повышении температуры образуются ди- и полизамещенные производные.
Бромирование фенантрена приводит к довольно устойчивому продукт присоединения, который при нагреве отщепляет HBr, превращаясь в 9-бромфенантрен.
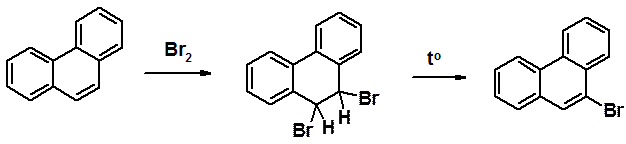
Другие реакции SEAr приводят к сложным смесям. В результате нитрования фенантрена образуется 36% 9-, 26% - 1- и 22% - 3-нитропроизводного. Сульфирование дает 13% 9-, 8% - 1-, 18% -2 и 18% - 3-фенентренсульфониевых кислот.
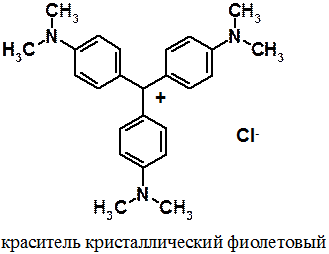
Недостаток электронной плотности метанового углерода компенсируется ароматическими 6p-электронами трех бензольных колец. Иногда говорят, что положительный заряд «размазан» по всей молекуле. Аналогично (с точностью до наоборот) объясняется стабильность трифенилметильного аниона и радикала. Введение в бензольные кольца заместителей способно заметно увеличить стабильность образующихся в ходе реакций трифенилметильных ионов. Как было показано ранее, донорные заместители стабилизируют катионы, акцепторные – анионы. Наличие в орто - и/или пара -положениях бензольных циклов донорных заместителей увеличивает стабильность трифенилметильного катиона, а акцепторных – аниона. Например, три-(пара -диметиламинофенил)хлорметан (кристаллический фиолетовый) в водном растворе полностью диссоциирован на ионы.
 2014-02-02
2014-02-02 6766
6766








