Феноменологическое определение энтропии позволяет найти в обратимом процессе лишь ее изменение, а не абсолютную величину. Последнюю можно найти на основе третьего закона термодинамики.
На основе опытных данных Нернст (1906) сформулировал гипотезу, получившую название теоремы Нернста: «При всех изменениях, происходящих в чистых веществах при абсолютном нуле, изменение энтропии равно нулю». Таким образом
 . (10.1)
. (10.1)
Планк предложил энтропию тела при абсолютном нуле принять равной нулю:
 . (10.2)
. (10.2)
Теорема Нернста не следует из первого и второго законов термодинамики, а связана с третьим законом термодинамики, которая гласит, что никакую систему невозможно охладить до абсолютного нуля.
Рассмотрим систему, охлаждаемую от температуры T 1 до T 2 путем изменения внешнего параметра l (например, объема V или магнитного поля 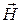 ). Температура окружающих тел выше, поэтому для достижения самых низких температур процесс должен быть адиабатическим, т.е. энергия системы должна уменьшаться за счет совершения ею работы. Охлаждение будет наиболее эффективным, если процесс является обратимым, так как в обратимом адиабатическом процессе работа максимальна (
). Температура окружающих тел выше, поэтому для достижения самых низких температур процесс должен быть адиабатическим, т.е. энергия системы должна уменьшаться за счет совершения ею работы. Охлаждение будет наиболее эффективным, если процесс является обратимым, так как в обратимом адиабатическом процессе работа максимальна (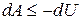 ). Для адиабатического процесса
). Для адиабатического процесса
|
|
|
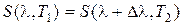 . (10.3)
. (10.3)
Допустим, что достигли T 2 = 0. Тогда, используя разложение
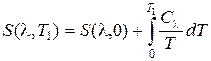 , (10.4)
, (10.4)
где 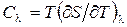 – теплоемкость системы при l = const, можем записать
– теплоемкость системы при l = const, можем записать
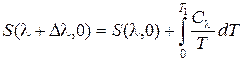 . (10.5)
. (10.5)
Теплоемкость C l положительна, поэтому при T = 0 получаем
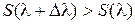 . (10.6)
. (10.6)
Но, поскольку, согласно третьему закону термодинамики невозможно от температуры T 1 > 0 охладить систему до T 2 = 0, можно заключить, что
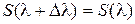 при T = 0. (10.7)
при T = 0. (10.7)
Это утверждение совпадает с теоремой Нернста (1).
Из формулы (5) при условии (7) получаем
 при T ® 0, (10.8)
при T ® 0, (10.8)
откуда следует, что теплоемкость C l системы стремится к нулю при T ® 0.
 2014-02-24
2014-02-24 760
760








