Впервые подобная корреляция была установлена в 1924 г. Бренстедом для процессов кислотно-основного катализа и несколько позже обобщена в работах Поляни. Связь между изменениями энергии активации и теплот химических превращений – соотношение Бренстеда – Поляни, записывается в следующей форме:
Е = Еo ± αq
ΔЕ = ± αq,
где Е – энергия активации, q – теплота химической реакции, причем Еo>0 и 0 < α < 1.
Это соотношение имеет фундаментальное значение для химической кинетики. Обобщение обширного экспериментального материала по взаимодействию радикалов и атомов показывает, что почти во всех случаях связь между энергией активации Е и теплотой реакции q может быть представлена выражением:
E = 11,5 – 0,25q - экзотермические реакции
E = 11,5 + 0,75q - эндотермические реакции
Форма найденной зависимости указывает на ограниченность ее применения. Действительно, при q >46 E – отрицательна, что не имеет смысла. Соотношение этого вида справедливы лишь в пределах отдельных групп реакций, когда изменение природы компонента, меняя теплоту реакции, не влияет заметно на характер взаимодействия. Несмотря на указанную ограниченность соотношение Бренстеда – Поляни очень важно для химической кинетики. И, в частности, для явлений катализа, и служит пока основным средством предвидения изменения скорости реакции при вариации катализатора. Условия, при которых выполняется соотношение Бренстеда – Поляни, можно качественно наглядно установить при рассмотрении, в виде примера, простой реакции обменного взаимодействия радикала с молекулой:
R’ + RB → R + R’B,
где R и R’ – атомы или радикалы, В – атом, связанный с радикалами.
Энергетическая схема протекания реакции представлена на рисунке в координатах: t – путь реакции, Е – энергия системы, отсчитывается от состояния, отвечающего диссоциации соединений (R, B, R’).
Рассмотрим группу реакций, в которых меняется только природа радикала R, в то время как R’ и В остаются неизменными. Предположим, что влияние изменений R на энергию всех состояний в системе R, B, R’ можно выразить с помощью некоторого параметра λ, зависящего от природы R и λ = 0 для стандартного радикала 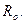 Конкретный физический смысл этого параметра не имеет значения для дальнейших рассуждений. Изменение R будет изменять форму кривой потенциальной энергии системы. Энергия исходного состояния
Конкретный физический смысл этого параметра не имеет значения для дальнейших рассуждений. Изменение R будет изменять форму кривой потенциальной энергии системы. Энергия исходного состояния 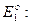
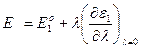 ;
;
где: 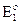 – энергия исходного состояния для радикала Ro. При принятой системе отсчета энергия конечного состояния
– энергия исходного состояния для радикала Ro. При принятой системе отсчета энергия конечного состояния 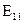 не зависит от природы R и для всех радикалов остается такой же, как и для
не зависит от природы R и для всех радикалов остается такой же, как и для 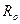 :
:
RII = EoII;
Энергия активного комплекса:
E* = E*o + λ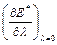 ;
;
где: E*o – энергия активного комплекса для Ro.
Отсюда теплота реакции:
q = EI – EII = EoI – EoII + λ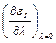 = qo + λ
= qo + λ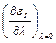 ;
;
где: qo – теплота реакции для Ro.
Энергия активации реакции:
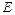 =
= 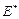 –
– 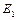 =
= 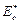 + λ
+ λ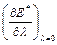 –
– 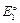 – λ
– λ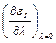 =
= 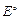 – λ
– λ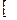
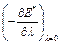 +
+ 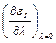
 ;
;
Исключив λ из уравнений, находим:
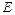 =
= 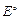 +
+ 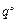
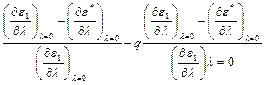
Обозначим:
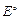 +
+ 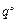
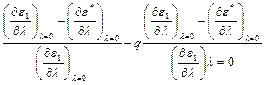

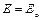 -
- 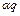 .
.
Будет совпадать с уравнением Бренстеда – Поляни при условии:
1. 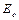 > 0, 0 < α < 1 и
> 0, 0 < α < 1 и
2. Постоянство 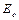 и
и 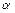 .
.
В активных комплексах расстояния между атомами несколько увеличены и связи между ними «разрыхлены» по сравнению с исходными молекулами. Это дает основание полагать, что изменение энергии активного комплекса при изменении природы радикала R, будут всегда меньше соответствующих изменений энергии исходного состояния:
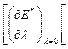
Для постоянства Eo и α необходимо кроме того, чтобы относительное изменение 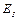 и
и 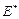 в рассматриваемом ряду радикалов R было постоянным:
в рассматриваемом ряду радикалов R было постоянным:
Открывает подход к проблеме. Позволяет найти связь между скоростью и энергией промежуточных взаимодействий.
 2014-02-12
2014-02-12 3227
3227








